题目内容
8.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
分析 (1)根据反应物和生成物结合质量守恒定律来书写化学方程式;
(2)根据所配溶液的体积选择容量瓶;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)先计算NaOH的浓度,由于第二次滴定时数据与另外两次差别较大,舍去,则消耗滤液的体积平均值为$\frac{20.02+19.98}{2}$=20.00mL,根据c(滤液)=$\frac{c(NaOH)V(NaOH)}{V(滤液)}$计算;
(5)俯视标准液液面,则滤液的体积偏小,根据c(滤液)=$\frac{c(NaOH)V(NaOH)}{V(滤液)}$分析误差.
解答 解:(1)TiCl4水解生成TiO2•xH2O,设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O+4HCl;
(2)配制成250mL溶液使用的量具是250mL容量瓶,故答案为:250mL容量瓶;
(3)酚酞在氢氧化钠溶液中显红色,随着反应进行碱性减弱,溶液颜色变浅,当溶液颜色由粉红色变为无色,且半分钟内不变色,可说明达到滴定终点,
故答案为:浅红色溶液变为无色,且半分钟内不变色;
(4)1.000gNaOH固体质量,配制成250mL溶液,则c(NaOH)=$\frac{n}{V}$=$\frac{\frac{1g}{40g/mol}}{0.25L}$=0.1mol/L,
第二次滴定时数据与另外两次差别较大,舍去,则消耗滤液的体积平均值为$\frac{20.02+19.98}{2}$=20.00mL,
则c(滤液)=$\frac{c(NaOH)V(NaOH)}{V(滤液)}$=$\frac{0.1mol/L×0.025L}{0.02L}$=0.125 mol•L-1,
故答案为:0.125 mol•L-1;
(5)若在滴定终点读取滴定管刻度时,俯视液面,则滴定管中读出的滤液的体积偏小,由c(滤液)=$\frac{c(NaOH)V(NaOH)}{V(滤液)}$可知,计算结果偏大,即测定结果偏高,
故答案为:偏高.
点评 本题考查酸碱中和滴定,明确中和滴定实验的仪器、步骤、终点的判定、数据处理等即可解答,注意滴定管的读数为易错点,题目难度中等.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | K2SO4•2Cr2(SO4)3 | B. | 2K2SO4•Cr2(SO4)3 | C. | K2SO4•Cr2(SO4)3 | D. | K2SO4•$\frac{1}{2}$Cr2(SO4)3 |
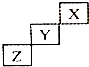
| A. | X是种活泼的非金属元素 | |
| B. | Z的最高价氧化物的水化物是一种弱酸 | |
| C. | Y的氢化物很稳定 | |
| D. | Y元素的最高化合物为+7价 |
| A. | FeCl3溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | NaOH溶液 |
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | MgSO4 |
| A. | 苯甲酸的重结晶实验中要得到纯净的苯甲酸固体需要进行两次过滤操作 | |
| B. | 实验室制乙烯时,为减弱浓硫酸对有机物的碳化作用,应用小火缓慢加热 | |
| C. | 在石油的分馏、制硝基苯、制乙烯的实验中,都要使温度计的水银液泡浸入反应液中,以控制实验温度 | |
| D. | 制备硝基苯,混合药品的顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 |
| A. | 化学式为CF2Cl2的物质可以看作是甲烷的衍生物,它有两种分子结构 | |
| B. | 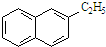 所有原子都处于同一平面 所有原子都处于同一平面 | |
| C. | C3H8O有2种同分异构体 | |
| D. | 甲苯的二氯代物共有10种 |
| A. | 铝原子的结构示意图: | B. | 乙炔的比例模型: | ||
| C. | 水分子的电子式: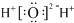 | D. | 硝基苯的结构简式: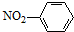 |
| A. | $\frac{n}{16}$ | B. | $\frac{n}{8}$ | C. | 4n | D. | 8n |