题目内容
11.要证明某溶液中不含Fe3+ 而可能含有Fe2+,应进行的实验操作及最佳顺序为:①加入少量氯水;②加入少量KMnO4溶液;③加入少量KSCN溶液( )| A. | ①③ | B. | ②③ | C. | ③① | D. | ①②③ |
分析 三价铁离子遇到硫氰根离子显血红色;
二价铁离子遇到硫氰根离子不变色,二价铁离子具有还原性,能被氧化为三价铁离子;
高锰酸钾溶液为紫红色.
解答 解:先根据Fe3+的特征反应,加入硫氰酸钾溶液判断溶液不含Fe3+;然后加入氧化剂氯水,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在,注意高锰酸钾溶液为紫红色,不反应溶液也可以变红,所以不能选用高锰酸钾氧化二价铁离子,故C正确;
故选:C.
点评 本题考查了三价铁离子和二价铁离子的检验,题目难度不大,熟悉三价铁离子和二价铁离子的性质是解题的关键,注意氧化二价铁离子时不选高锰酸钾因为高锰酸钾为紫红色现象不容易判断.

练习册系列答案
相关题目
1.下列措施一定能使化学反应速率加快的是( )
| A. | 增大反应物的量 | B. | 增大压强 | C. | 升高温度 | D. | 减少生成物的量 |
19.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
3.下列说法正确的是( )
| A. | 核磁共振仪、红外光谱仪、质谱仪、紫外光谱仪、元素分析仪、紫外可见分光光度计等都是定性或定量研究物质组成或结构的现代仪器 | |
| B. | 利用元素周期律,人们在过渡元素中寻找各种性能优良的催化剂,使反应的温度降低并提高反应物的转化率,从而起到很好的节能效果 | |
| C. | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | |
| D. | 分液、蒸馏、渗析、层析及色谱法、钠融法等都是混合体系分离提纯常用的方法 |
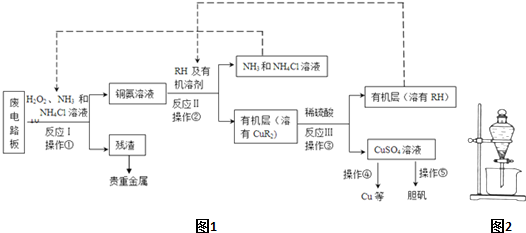
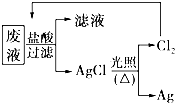 国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题: