题目内容
9.向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图1所示.试回答:
(1)AB段所表示的反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O;
CD段所表示的反应的离子方程式是AlO2-+H++H2O═Al(OH)3↓.
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
(3)a是NaOH,且c(a):c(b)=1:1
(4)原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.取4.53g硫酸铝铵晶体[Al2(NH4)2(SO4)n•24H2O,相对分子质量为906]加热分解,最终剩余0.51gAl2O3固体.加热过程中,固体质量随时间的变化如图2所示.
试通过计算确定400℃剩余固体成分的化学式(NH4)2Al2(SO4)4•H2O.(写出计算过程)
分析 (1)氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝;
(2)偏铝酸钠中通入二氧化碳会发生反应生成碳酸钠、氢氧化铝沉淀,据此书写反应;
(3)根据产生沉淀的量的变化以及沉淀的溶解情况确定先后滴加的试剂;
(4)氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,根据沉淀的量结合元素守恒来回答;
(5)先计算硫酸铝铵晶体质量,根据化学式计算结晶水中水的质量,结合400℃时固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[((NH4)2Al2(SO4)4]:n(H2O),据此确定化学式.
解答 解:(1)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定AB段所表示的反应的离子方程式是:Al(OH)3+OH-═AlO2-+2H2O,CD段所表示的反应的离子方程式是:AlO2-+H++H2O═Al(OH)3↓,故答案为:Al(OH)3+OH-═AlO2-+2H2O;AlO2-+H++H2O═Al(OH)3↓;
(2)沉淀量达到最小后,氢氧化铝全部转化为偏铝酸钠,通入二氧化碳会发生反应:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定a是NaOH,b是HCl,根据图象,结合图象消耗的酸碱体积的完全的对称的特点,根据反应实质:NaOH~Al(OH)3~AlO2-~H+,得到:盐酸和氢氧化钠的浓度之比是1:1,故答案为:1:1;
(4)原混合液中,加入氢氧化钠产生的氢氧化铝和氢氧化镁的物质的量是相等的,根据元素守恒,所以氯化镁和氯化铝的物质的量是相等的,氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,所以c(Al3+):c(Mg2+):c(Cl-)=1:1:5,故答案为:1:1:5;
(5)4.53g硫酸铝铵晶体的物质的量为$\frac{4.53g}{906g/mol}$=0.005mol,
4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为$\frac{2.16g-2.07g}{18g/mol}$=0.005mol,
剩余固体中n[(NH4)2Al2(SO4)4]:n(H2O)=0.005mol:0.005mol=1:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
故答案为:(NH4)2Al2(SO4)4•H2O.
点评 本题考查了镁、铝重要化合物的性质、根据化学式的计算等知识,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 家用的铝窗 | B. | 温度计用的水银 | C. | 铸造用的黄铜 | D. | 建筑用的钢铁 |
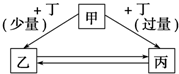 甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )
甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )| A. | NaOH溶液 | B. | Fe | C. | Al2O3 | D. | C |
 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 电解质 |
| 属于该类的物质 |
(3)⑤的稀溶液和⑨的混合溶液100mL,向其中逐渐加入②,产生气体的量随②质量增加的变化如下图所示.
回答下列问题:
①标准状况下,收集到的气体的总体积是4.48L.
②原混合溶液中硫酸的物质的量浓度是2.5mol/L.
(4)将⑤的稀溶液逐滴滴加到⑦中,实验现象是先生成红褐色沉淀,继续加入沉淀溶解.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL的水洗涤.有机层继续用10mL 10% Na2CO3洗涤至中性,再用10mL的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯滤入50mL烧瓶中,常压蒸馏,收集125~127℃的馏分,得11.6g乙酸正丁酯
请回答有关问题.
(1)冷水应该从冷凝管a(填a或b)管口通入.
(2)步骤①中不断从分水器下部分出生成的水的目的是使用分水器分离出水,使平衡正向移动,提高反应产率,步骤①中判断反应终点的依据是分水器中的水层量不再增加.
(3)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(4)下列关于分液漏斗的使用叙述正确的是D
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是80%.
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
 按如图装置进行如下实验,请用你所学知识完成下题:
按如图装置进行如下实验,请用你所学知识完成下题: