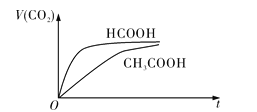
题目内容
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___,3d能级上的未成对电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是___。
(3)单质铜及镍都是由___键形成的晶体;元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(4)某镍白铜合金的立方晶胞结构如图所示。
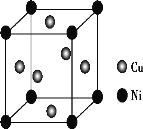
①晶胞中铜原子与镍原子的数量比为___。
【答案】1s22s22p63s23p63d84s2 2 正四面体 配位键 N 高于 氨气分子间有氢键,分子间作用力更强 金属 Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的 3:1
【解析】
(1)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,3d能级上的未成对电子数为2,
故答案为:1s22s22p63s23p63d84s2;2;
(2)①SO![]() 中S原子的孤电子对数=
中S原子的孤电子对数=![]() =0,价层电子对数=4+0=4,离子空间构型为正四面体,
=0,价层电子对数=4+0=4,离子空间构型为正四面体,
故答案为:正四面体;
②Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键,
故答案为:配位键;N;
③PH3分子之间为范德华力,氨气分子之间形成氢键,分子间作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的,
故答案为:高于;氨气分子之间形成氢键,分子间作用力更强;
(3)单质铜及镍都属于金属晶体,都是由金属键形成的晶体;Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的,
故答案为:金属;Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的;
(4)①晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×![]() =1、Cu原子数目=6×
=1、Cu原子数目=6×![]() =3,故Cu与Ni原子数目之比为3:1,
=3,故Cu与Ni原子数目之比为3:1,
故答案为:3:1;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D