题目内容
【题目】W、X、Y、Z、T均为短周期元素,X、Y、T原子最外层电子数之和为18。下列说法正确的是
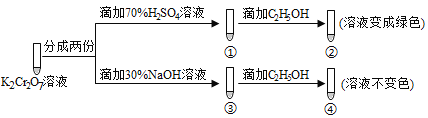
![]()
A.X、Y、T三种元素最低价氢化物的沸点依次升高
B.X、Y和氢三种元素可共同形成离子化合物或共价化合物
C.物质WY2、ZY2一定都有熔点高、硬度大的特性
D.元素X、Y、T的最高正价的顺序为:T>Y>X
【答案】B
【解析】
五种元素W、X、Y、T、Z均为短周期元素,设X最外层电子数为a,则Y、T最外层电子数依次为a+1、a+2,X、Y、T原子最外层电子数之和为18,则3a+3=18,解得a=5,故W为C、Z为Si、X为N、Y为O、T为Cl元素,据此分析。
五种元素W、X、Y、T、Z均为短周期元素,设X最外层电子数为a,则Y、T最外层电子数依次为a+1、a+2,X、Y、T原子最外层电子数之和为18,则3a+3=18,解得a=5,故W为C、Z为Si、X为N、Y为O、Z为Cl元素。
A. X、Y、T三种元素最低价氢化物NH3、H2O、SiH4的沸点比较中H2O最高,因为水分子间存在氢键,选项A错误;
B. X、Y和氢三种元素可共同形成离子化合物NH4NO3或共价化合物HNO3等,选项B正确;
C. 物质WY2即(CO2)为分子晶体 ,熔点低、硬度小,选项C错误;
D. 元素X、T的最高正价分别为+5、+4,Y没有最高正价,选项D错误。
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
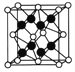
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。