题目内容
【题目】天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
①CH3OCH3(g)+H2O(g)2CH3OH(g);△H=37kJmol-1
②CH3OH(g)+H2O(g)3H2(g)+CO2(g);△H=49kJmol-1
③CO2(g)+H2(g)CO(g)+H2O(g);△H=41.3kJmol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为______________.
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为______________.
(3)下列采取的措施和解释正确的是______________(填字母).
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)CH3OH(g);△H<0.现将10molCO与20molH2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA________tB(填“大于”“小于”或“等于”).
②A、C两点的平衡常数KA____KC(填“大于”“小于”或“等于”).

【答案】 3CH4+CO2→2CH3OCH3 CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) ΔH=+135kJ·mol-1 ABD 大于 大于
6H2(g)+2CO2(g) ΔH=+135kJ·mol-1 ABD 大于 大于
【解析】(1)二甲醚可以通过天然气和CO2合成制得,反应的化学方程式为:3CH4+CO2-→2CH3OCH3,故答案为:3CH4+CO2-→2CH3OCH3;
(2)①CH3OCH3(g)+H2O(g)2CH3OH(g)△H=37kJmol-1;
②CH3OH(g)+H2O(g)3H2(g)+CO2(g)△H=49kJmol-1;
③CO2(g)+H2(g)CO(g)+H2O(g)△H=41.3kJmol-1;
依据盖斯定律①+②×2得到,CH3OCH3(g)与水蒸气制氢气的热化学方程式为:CH3OCH3(g)+3H2O(g)6H2(g)+2CO2(g)△H=135 kJmol-1;故答案为:CH3OCH3(g)+3H2O(g)6H2(g)+2CO2(g)△H=135 kJmol-1;
(3)A.反应①②③是吸热反应,反应过程在低温进行,化学平衡逆向进行,一氧化碳减少,可减少CO的产生,故A正确;
B.增加进水量,对反应①起到促进作用,对③起到抑制作用,所以有利于二甲醚的转化,并减少CO的产生,故B正确;
C.选择在高温具有较高活性的催化剂,加快反应速率,但不能改变化学平衡,不能提高反应②CH3OH的转化率,故C错误;
D.体系压强升高,对反应②反应逆向进行,对制取氢气不利,二氧化碳和氢气量减小,对反应③逆向进行,能减少CO的产生,故D正确;故答案为:ABD;
(4)反应开始至平衡,依据图象分析可知一氧化碳转化率在B点转化率大于A点的转化率,反应速率快,需要时间短,所以tA>tB;AC点转化率相同,但C点温度高于A点,化学平衡是放热反应,升高温度,平衡逆向进行,C点的平衡常数小于A点;即KA>KC,故答案为:大于;大于。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO47H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: .
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3 , 也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.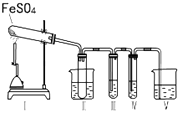
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在(选填“0℃、25℃、50℃”),装置Ⅱ的作用是 .
②装置Ⅲ中的试剂可以是(选填序号,下同),现象是 , 则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是 .
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 .
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=
(精确到0.1%)