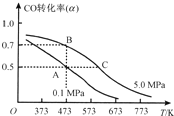
题目内容
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。H2S与CO2在高温下反应可制得COS: H2S(g)+CO2(g)![]() COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在 2 L 容器中充入一定量的H2S和CO2发生上述反应,数据如下:
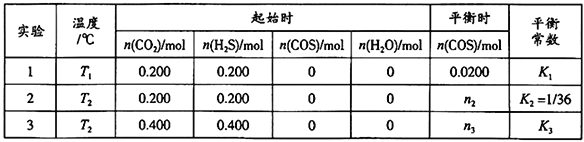
下列判断不正确的是
A. K1=l/81 B. K2=K3 且n3=2n2
C. 初始反应速率:实验3 >实验2 >实验1 D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
【答案】D
【解析】A.根据表格数据,平衡时H2O(g)的物质的量与COS的物质的量相等,都是0.0200mol,则CO2和H2S的物质的量均为0.200mol-0.0200mol=0.1800mol,K1=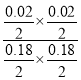 =
=![]() ,故A正确;B. 温度不变,平衡常数不变,因此K2=K3,根据方程式,反应前后气体的物质的量不变,增大压强,平衡不移动,起始时反应物的物质的量实验3是实验2的两倍,因此平衡时COS的物质的量,实验3也是实验2的两倍,即n3=2n2,故B正确;C. 实验3 与实验2相比,实验3浓度大,反应速率大,实验2 与实验1相比,实验1的平衡常数比实验2大,说明实验1是实验2的平衡状态正向移动的结果,由于该反应正反应为吸热反应,因此实验1的温度比实验2低,反应速率慢,因此初始反应速率:实验3 >实验2 >实验1,故C正确;D. 根据平衡常数K=
,故A正确;B. 温度不变,平衡常数不变,因此K2=K3,根据方程式,反应前后气体的物质的量不变,增大压强,平衡不移动,起始时反应物的物质的量实验3是实验2的两倍,因此平衡时COS的物质的量,实验3也是实验2的两倍,即n3=2n2,故B正确;C. 实验3 与实验2相比,实验3浓度大,反应速率大,实验2 与实验1相比,实验1的平衡常数比实验2大,说明实验1是实验2的平衡状态正向移动的结果,由于该反应正反应为吸热反应,因此实验1的温度比实验2低,反应速率慢,因此初始反应速率:实验3 >实验2 >实验1,故C正确;D. 根据平衡常数K=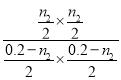 =
=![]() ,解得n2≈0.0286 mol,则c(COS) 约为0.0143 mol·L-1,故D错误;故选D。
,解得n2≈0.0286 mol,则c(COS) 约为0.0143 mol·L-1,故D错误;故选D。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目