题目内容
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO47H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: .
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3 , 也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.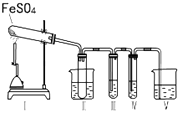
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在(选填“0℃、25℃、50℃”),装置Ⅱ的作用是 .
②装置Ⅲ中的试剂可以是(选填序号,下同),现象是 , 则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是 .
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 .
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=
(精确到0.1%)
【答案】
(1)4FeSO4?7H2O+O2=4Fe(OH)SO4+26H2O
(2)50℃;防止产生倒吸;C;产生白色沉淀;BE;SO2+2OH﹣=SO32﹣+H2O;KSCN溶液;溶液变成血红色;固体中含有FeO;35.7%
【解析】解:(1)亚铁离子具有还原性,易被氧气氧化,反应方程式为:4FeSO47H2O+O2=4Fe(OH)SO4+26H2O,所以答案是:4FeSO47H2O+O2=4Fe(OH)SO4+26H2O;(2)①SO3的沸点是44.8°C,当温度高于44.8°C时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),所以答案是:50℃;防止产生倒吸:②装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也能使酸性高锰酸钾溶液褪色,所以可以选用二者来检验二氧化硫;所以答案是:C;产生白色沉淀;B、E;③二氧化硫会污染空气,所以要用氢氧化钠溶液来吸收剩余的二氧化硫,其反应的离子方程式为:SO2+2OH﹣=SO32﹣+H2O,所以答案是:SO2+2OH﹣=SO32﹣+H2O;④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;所以答案是:
操作步骤 | 预期实验现象 | 预期实验结论 |
KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | |
固体中含有FeO |
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3 , 完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,设生成的二氧化硫为xmol,三氧化硫为ymol,根据硫元素守恒,则x+y= ![]() =0.15mol, 64x+80y=22.8g﹣11.2g=11.6g,解得:x=0.025,y=0.125, FeSO4固体分解,每生成1mol二氧化硫时硫元素得到2mol电子,每生成1molFe2O3时铁元素失去2mol电子,所以生成的二氧化硫与氧化铁的物质的量相同,则Fe2O3的物质的量为0.025mol,其质量为0.025mol×160g/mol=4.0g,故质量分数为:
=0.15mol, 64x+80y=22.8g﹣11.2g=11.6g,解得:x=0.025,y=0.125, FeSO4固体分解,每生成1mol二氧化硫时硫元素得到2mol电子,每生成1molFe2O3时铁元素失去2mol电子,所以生成的二氧化硫与氧化铁的物质的量相同,则Fe2O3的物质的量为0.025mol,其质量为0.025mol×160g/mol=4.0g,故质量分数为: ![]() ×100%=35.7%,所以答案是:35.7%.
×100%=35.7%,所以答案是:35.7%.

