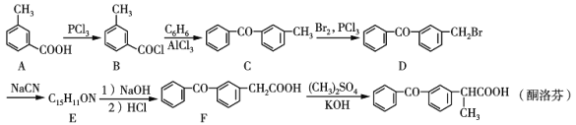
题目内容
【题目】常温下,用0.1000mol·L-1 的盐酸滴定 20.00 mL 未知浓度的氨水,滴定曲线如图所示,滴加 20. 00 mL 盐酸时所得溶液中 c (Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)。下列说法错误的是
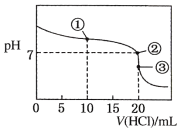
A.点①溶液中 c( NH4+)+c ( NH3·H2O)+c(NH3)=2c (Cl-)
B.点②溶液中 c( NH4+)=c (Cl-)
C.点③溶液中 c (Cl-)> c( H+)>c (NH4+)>c(OH-)
D.该氨水的浓度为 0.1000mol·L-1
【答案】C
【解析】
条件“滴加 20. 00 mL 盐酸时所得溶液中 c (Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)”中的等式,实际上是溶液中的物料守恒关系式;进一步可知,V(HCl)=20mL即为滴定终点,原来氨水的浓度即为0.1mol/L。V(HCl)=20mL即滴定终点时,溶液即可认为是NH4Cl的溶液,在此基础上分析溶液中粒子浓度的大小关系,更为简便。
A.V(HCl)=20mL时,溶液中有c(Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)成立;所以V(HCl)=10mL也就是20mL的一半时,溶液中就有以下等式成立:c( NH4+)+c ( NH3·H2O)+c(NH3)=2c (Cl-);A项正确;
B.点②时溶液呈中性,所以有c(H+)=c(OH-);根据电荷守恒式:c(H+)+c(NH4+)=c(OH-)+c(Cl-),可知溶液中c(NH4+)= c(Cl-);B项正确;
C.点③即为中和滴定的终点,此时溶液可视作NH4Cl溶液;由于NH4+的水解程度较小,所以c(NH4+)>c(H+);C项错误;
D.由条件“滴加 20. 00 mL 盐酸时所得溶液中 c (Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)”可知V(HCl)=20mL即为滴定终点,那么原来氨水的浓度即为0.1mol/L;D项正确;
答案选C。