题目内容
【题目】某有机物完全燃烧生成CO2和水。将12g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g;再通过碱石灰,碱石灰增重26.4g,该有机物的分子式为( )
A. C4H10OB. C2H6OC. C3H8OD. C2H4O
【答案】C
【解析】
根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式。
浓硫酸增重可知水的质量为14.4g,可计算出n(H2O)=![]() =0.8mol,n(H)=1.6mol,m(H)=1.6g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.8mol,n(H)=1.6mol,m(H)=1.6g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=![]() =0.6mol,m(C)=7.2g,m(C)+m(H)=8.8g,有机物的质量为12g,所以有机物中氧的质量为3.2g,n(O)=
=0.6mol,m(C)=7.2g,m(C)+m(H)=8.8g,有机物的质量为12g,所以有机物中氧的质量为3.2g,n(O)=![]() =0.2mol, n(C):n(H):n(O)=0.6mol:1.6mol:0.2mol=3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O;故答案为C。
=0.2mol, n(C):n(H):n(O)=0.6mol:1.6mol:0.2mol=3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O;故答案为C。

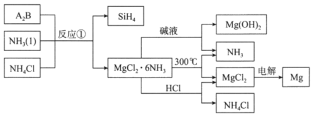
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。
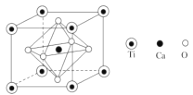
(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)