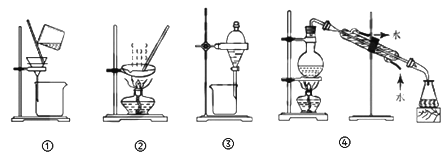
��Ŀ����
����Ŀ��Ǧ��������緢�ֺ�ʹ�õ�һ���ؽ�������ҵ����Ǧ����(��Ҫ�ɷֺ�PbS)Ϊԭ�ϣ��ֻ�ʪ�����ַ���ұ����
��ұ����Ǧ���������£�

(1)����¯����Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________________��
(2)�ķ�¯�н�̿��������___________���������з�Ӧ�����ӷ���ʽΪ___________��
��ʪ����Ǧ�Ĺ����������£�

��֪���ٲ�ͬ�¶���PbCl2���ܽ�����±���ʾ��

��PbCl2Ϊ������ˮ��������ʣ��ں�Cl������Һ�д���ƽ�⣺
PbCl2(aq)+2Cl��(aq)![]() PbCl42��(aq)��
PbCl42��(aq)��
(3)��ȡ�����з�����Ӧ�����ӷ���ʽΪ______________________��
(4)����aΪ������ˮϡ�Ͳ���ȴ���ò�����������Һ1��PbCl2��������������Ľ���Ϊ___________��
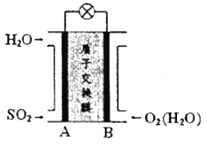
(5)����Һ3����Һ2�ֱ�������ͼ��ʾ���װ�õ����������У�����ȡ����Ǧ��ʹ��ȡҺ�е�FeCl3���������������еĵ缫��ӦʽΪ___________�����õ��װ�õ���ӵ�ԴΪǦ���أ�ÿ����20.7gǦ��Ǧ������������������ʵ���Ϊ___________��

(6)Ŀǰ��Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ���___________��
���𰸡�2PbS+3O2![]() 2PbO+2SO2 ����ԭ�� SO2+2NH3H2O=SO32- + 2NH4++H2O PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+ ϡ��������PbCl2(aq)+2Cl-(aq)
2PbO+2SO2 ����ԭ�� SO2+2NH3H2O=SO32- + 2NH4++H2O PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+ ϡ��������PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2������ PbCl42-+2e- = Pb+4Cl- 0.2mol ����������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ش�һ�����ɣ�
PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2������ PbCl42-+2e- = Pb+4Cl- 0.2mol ����������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ش�һ�����ɣ�
��������
��1������¯�з�������PbS��������Ӧ����PbO��SO2��
��2���ķ�¯�н�̿������������ԭ�����������з�������SO2������ˮ�ķ�Ӧ������������狀�ˮ��
��3�������̿�֪����ȡ�����з�������PbS�ͽ�ȡҺ�ķ�Ӧ��Fe3+����ԭΪFe2+,-2��S������ΪS���ʡ�
��4������ˮ�Ժ�������Ũ�ȼ�С������ƽ�����ƣ��ɱ���ã�����PbCl2�ܽ�Ƚ��ͣ��ٽ�PbCl2������
��5���˵��װ��Ŀ������ȡǦ����Һ3�������ң���Һ3�к���PbCl42���������õ��ӷ�����ԭ��Ӧ��
��6����Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ��Ǹ���������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߡ�
��1������¯�з�������PbS��������Ӧ����PbO��SO2����Ӧ�Ļ�ѧ����ʽΪ2PbS+3O2![]() 2PbO+2SO2���ʴ�Ϊ��2PbS+3O2
2PbO+2SO2���ʴ�Ϊ��2PbS+3O2![]() 2PbO+2SO2��
2PbO+2SO2��
��2���ķ�¯�н�̿������������ԭ�����������з�������SO2������ˮ�ķ�Ӧ������������狀�ˮ�������Ļ�ѧ����ʽΪSO2+2NH3H2O=(NH4)2SO3+H2O�����ӷ���ʽΪ��SO2+2NH3H2O=SO32-+2NH4++H2O ���ʴ�Ϊ����ԭ����SO2+2NH3H2O=SO32-+2NH4++H2O��
��3�������̿�֪����ȡ�����з�������PbS�ͽ�ȡҺ�ķ�Ӧ��Fe3+����ԭΪFe2+,-2��S������ΪS���ʣ����ӷ���ʽΪ��PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+���ʴ�Ϊ��PbS+2Fe3++4Cl- = S��+PbCl42-+2Fe2+��
��4������ˮ�Ժ�������Ũ�ȼ�С������ƽ�����ƣ��ɱ���ã�����PbCl2�ܽ�Ƚ��ͣ��ٽ�PbCl2�������ʴ�Ϊ��ϡ��������PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2��������
PbCl42-(aq)��ƽ�����ƣ�ʹPbCl2���ʵ���������ȴʹPbCl2���ܽ�ȼ��٣�������PbCl2��������
��5���˵��װ��Ŀ������ȡǦ����Һ3�������ң���Һ3�к���PbCl42���������õ��ӷ�����ԭ��Ӧ���������еĵ缫��ӦʽΪPbCl42-+2e- = Pb+4Cl-������Ǧ���صĹ���ԭ��
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O���ó�Pb��2H2SO4��20.7gǦ���ʵ���Ϊ0.1mol���������ĵ���������ʵ���Ϊ0.2mol���ʴ�Ϊ��PbCl42-+2e- = Pb+4Cl-��0.2mol��
2PbSO4+2H2O���ó�Pb��2H2SO4��20.7gǦ���ʵ���Ϊ0.1mol���������ĵ���������ʵ���Ϊ0.2mol���ʴ�Ϊ��PbCl42-+2e- = Pb+4Cl-��0.2mol��
��6����Ǧ�����Ի�Ϊ������ʪ����ǦҲ�������Ե��ŵ㣬���ŵ��Ǹ���������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߣ��ʴ�Ϊ������������Ⱦ�١�����ԭ�Ͽ�ѭ�����á����������ʸߡ�