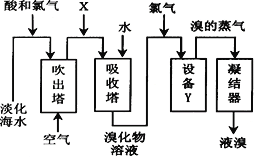
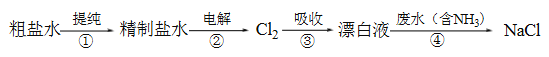题目内容
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
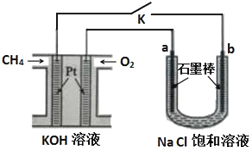
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
【答案】 CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O 变小 O2+2H2O+4e- =4OH- 变大 阳极 2Cl--2e- = Cl2↑ 阴极 2H++ 2e- = H2 ↑ b电极附近变红 2NaCl+2H2O![]() 2NaOH+ H2↑ + Cl2↑ 8mol 89.6L
2NaOH+ H2↑ + Cl2↑ 8mol 89.6L
【解析】本题考查原电池电极反应式的书写、电解原理的应用以及计算,(1)左边装置为燃料电池,通入甲烷的一极为负极,因为电解质为KOH溶液,因此负极反应式为CH4+10OH--8e-=CO32-+7H2O,根据负极反应式,消耗OH-,因此负极附近的pH变小;通入氧气一极为正极,反应式为O2+2H2O+4e-=4OH-,产生了OH-,则pH变大;(2)a与燃料电池的正极相连,即a电极为阳极,电极反应式为2Cl--2e-=Cl2↑,b电极连接燃料电池的负极,则b电极为阴极,电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,因此NaCl溶液中滴入酚酞,则b电极现象是b电极附近变红,总反应式为 2NaCl+2H2O ![]() 2NaOH+ H2↑ + Cl2↑;(3) 根据(1)1mol甲烷完全参与反应,转移电子物质的量为8mol,根据电子守恒,建立关系式为CH4~8e-~4Cl2,消耗1mol甲烷,a电极产生4molCl2,即氯气的体积为4×22.4L=89.6L。
2NaOH+ H2↑ + Cl2↑;(3) 根据(1)1mol甲烷完全参与反应,转移电子物质的量为8mol,根据电子守恒,建立关系式为CH4~8e-~4Cl2,消耗1mol甲烷,a电极产生4molCl2,即氯气的体积为4×22.4L=89.6L。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案