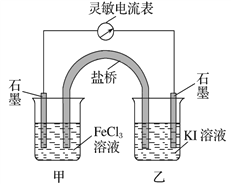
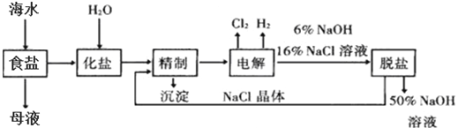
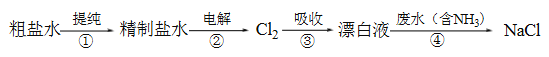题目内容
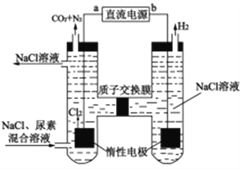
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
【答案】 正 Pb+SO42--2e-=PbSO4 增大 32 阳 4OH――4e-=2H2O+O2↑ CuO
【解析】电解中发现Ag电极有气体产生,则Ag电极上发生2H++2e-=H2↑,则Ag电极为阳极,因此A为负极,B为正极。甲池中铁电极为阳极,Fe-2 e-=Fe2+;乙池中锌为阴极,Cu2++2 e-=Cu,C为阳极,4OH――4e-=2H2O+O2↑。
(1)根据上述分析,B是铅蓄电池的正极,A为负极,放电过程中A电极反应式为Pb+SO42--2e-=PbSO4,故答案为:正;Pb+SO42--2e-=PbSO4;
(2)甲池中用铁作阳极电解稀硫酸,电极反应分别为2H++2e-=H2↑,Fe-2 e-=Fe2+,电解后甲池中硫酸的浓度减小,溶液的酸性减弱,电解液的pH增大;标准状况下11.2L的氢气的物质的量为0.5mol,转移电子1mol;根据电路中转移的电子守恒,Zn电极析出0.5molCu,质量为32g,故答案为:增大;32;
(3)根据上述分析,乙池中 C(碳)电极是阳极。C电极的电极反应式为4OH――4e-=2H2O+O2↑,锌为阴极,Cu2++2 e-=Cu,反应一段时间后,溶液中减少的元素有铜和氧,要使CuSO4溶液恢复到原浓度,需要向乙池中加入一定量的氧化铜固体或碳酸铜固体,故答案为:阳;4OH――4e-=2H2O+O2↑;CuO。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案