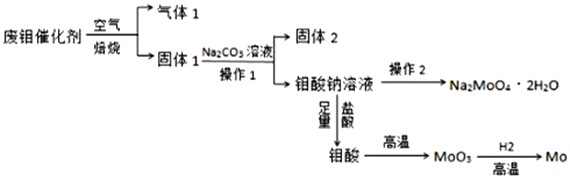
题目内容
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
A. 反应向逆反应方向进行
B. 反应向某方向进行一段时间后c(H2)<0.2 mol/L
C. 若升温后,K减小,说明该反应是吸热反应
D. 反应向某方向进行一段时间后K<57.0
【答案】B
【解析】根据题意,向此温度下的真空容器中充入0.2molL-1H2(g)、0.5molL-1I2(g)及0.3molL-1HI(g),Qc=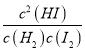 =
=![]() =9<K=57.0。A.反应向正反应方向进行,故A错误; B.反应向正方向进行一段时间后,反应物浓度减小,c(H2)<0.2 molL-1,故B正确;C.若升温后,K减小,说明平衡逆向移动,说明该反应是放热反应,故C错误;D.温度不变,平衡常数不变,故D错误;故选B。
=9<K=57.0。A.反应向正反应方向进行,故A错误; B.反应向正方向进行一段时间后,反应物浓度减小,c(H2)<0.2 molL-1,故B正确;C.若升温后,K减小,说明平衡逆向移动,说明该反应是放热反应,故C错误;D.温度不变,平衡常数不变,故D错误;故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目