题目内容
【题目】钕铁硼永磁合金因其具有优异的磁性能而被称为“磁王”,钕铁硼永磁合金中含有铁、硼及大量的稀土元素钕。
(1)基态铁原子的价层电子排布图为___________________,铁元素所在周期第一电离能最大的主族元素是________(填元素符号);已知基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外共有__________种类型的能级分布。
(2)硼与氢能形成类似于烃的一系列分子,如B2H6、B3H9、B4H10等。
①B2H6、B3H9、B4H10三种物质的沸点由低到高的顺序为__________________________;
②乙硼烷的结构式可表示为(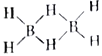 )已知反应B2H6+3O2
)已知反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
(3)硼酸分子中含有三个“-OH”,易溶于水,其易溶于水的主要原因是_________________。
(4)图1是三氧化二硼的一种球根模型图, 则硼原子、氧原子的杂化轨道类型分别为_____________。
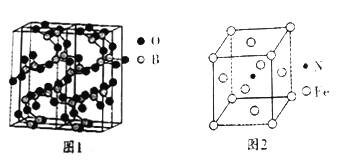
(5)铁元素与氮元素也能形成种磁性材料,其晶胞如图2所示,该磁性材料的化学式为__________;若该晶体的密度为p,铁原子、氮原子的半径分别为r(Fe)pm,r(N)pm,则该晶胞的空间利用率为_______(设阿伏加德罗常数的值为NA)。
【答案】 ![]() Br 4 B2H6<B3H9<B4H10 O>H>B 硼酸分子能与水分子间形成氢键 sp2 sp3 Fe4N
Br 4 B2H6<B3H9<B4H10 O>H>B 硼酸分子能与水分子间形成氢键 sp2 sp3 Fe4N ![]()
【解析】分析:(1)根据铁的价电子层为3d64s2,由泡利原理和洪特规则确定价层电子排布图;在同一周期中自左向右第一电离能有增大的趋势,Br在第四周期主族元素最右面,由此可确定;基态钕原子核外有s、p、d、f共4种类型的能级分布。(2)①分子晶体,相对分子质量越大,分子间作用力越大,沸点越高;②非金属性越强电负性越大;(3)氢键影响物质的溶解性;以此分析;(4)通过分析成键电子对和孤电子对数来确定杂化类型;(5)利用均摊法确定化学式,利用密度,求出一个晶胞的体积,一个晶胞中含有的所有原子体积之和与一个晶胞体积的百分比就是该晶胞的空间利用率。
详解:(1)铁的原子序数为26,价电子数为26-18=8,所以价电子层为3d64s2,由泡利原理和洪特规则知,铁原子的价层电子排布图为![]() ;在同一周期中自左向右第一电离能有增大的趋势,铁元素所在周期为第四周期,第一电离能最大的主族元素是Br;基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外有s、p、d、f共4种类型的能级分布。因此,本题正确答案为:
;在同一周期中自左向右第一电离能有增大的趋势,铁元素所在周期为第四周期,第一电离能最大的主族元素是Br;基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外有s、p、d、f共4种类型的能级分布。因此,本题正确答案为:![]() ; Br; 4
; Br; 4
(2)①B2H6、B3H9、B4H10三种物质均为分子晶体,沸腾时都破坏分子间作用力,相对分子质量Mr(B4H10)>Mr(B3H9)>Mr(B2H6),所以分子间作用力从B2H6到B4H10依次增大,沸点从B2H6到B4H10依次升高,所以B2H6<B3H9<B4H10。
②根据反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元素,B2H6中B的化合价没变和B2O3中B的化合价相同为+3价,则H的化合价为-1价,从而判断H、B、O三种元素的非金属性O>H>B,非金属性越强电负性越大,所以H、B、O三种元素电负性由大到小的顺序为O>H>B;B2H6共有12个价电子,形成4个σ键用去8个电子,还有4个电子形成2个相同的大π键,则构成一个大π键的原子、电子数目分别为4和2。
B2O3+2H2O中被氧化的元素是氢元素,B2H6中B的化合价没变和B2O3中B的化合价相同为+3价,则H的化合价为-1价,从而判断H、B、O三种元素的非金属性O>H>B,非金属性越强电负性越大,所以H、B、O三种元素电负性由大到小的顺序为O>H>B;B2H6共有12个价电子,形成4个σ键用去8个电子,还有4个电子形成2个相同的大π键,则构成一个大π键的原子、电子数目分别为4和2。
(3)硼酸分子中含有三个“-OH”,容易和水分子形成氢键,所以易溶于水的主要原因是硼酸分子能与水分子间形成氢键。
(4)从图1可知, 硼原子形成3个σ键,无孤对电子,所以为sp2 杂化;氧原子形成2个σ键,有两对孤对电子,所以为sp3 杂化,因此,本题正确答案为:sp2 ; sp3;
(5)从晶胞图知,一个晶胞中含有Fe原子=8![]() +6
+6![]() =4,含有N原子=1(体心),所以该磁性材料的化学式为Fe4N;一个晶胞的质量=
=4,含有N原子=1(体心),所以该磁性材料的化学式为Fe4N;一个晶胞的质量=![]() g=
g=![]() g,根据
g,根据![]() =
=![]() ,得一个晶胞的体积=
,得一个晶胞的体积=![]() =
=![]() ,4个铁原子的体积=4×
,4个铁原子的体积=4×![]() r3(Fe)×10-30cm3、1个氮原子的体积=4×
r3(Fe)×10-30cm3、1个氮原子的体积=4×![]() r3(N)×10-30cm3,,则该晶胞的空间利用率=(4个铁原子的体积+1个氮原子的体积)/一个晶胞的体积×100%=
r3(N)×10-30cm3,,则该晶胞的空间利用率=(4个铁原子的体积+1个氮原子的体积)/一个晶胞的体积×100%=![]() 。
。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】下列叙述不正确的是
选项 | 事实 | 原因 |
A | 钠保存在煤油中 | 钠在空气中会发生变化 |
B | 钠露置在空气中,迅速变暗 | 钠与氧气反应生成过氧化钠 |
C | 钠与水反应后滴入酚酞试剂,溶液变红 | 有碱性物质生成 |
D | 钠在加热条件下能与氧气反应生成淡黄色固体 | 钠有还原性 |
A. A B. B C. C D. D