题目内容
【题目】下列反应的离子方程式书写正确的是
A. 硫酸和氢氧化钡溶液混合:H++OH-=H2O
B. 铜与浓硫酸: Cu + 2H+ =Cu2+ + H2↑
C. 银片插入硝酸铜溶液中:Cu2++2Ag = Cu+2Ag+
D. 大理石与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
【答案】D
【解析】A. 硫酸和氢氧化钡溶液混合生成硫酸钡沉淀和水,A错误;B. 铜与浓硫酸加热时反应生成硫酸铜、SO2和H2O,不能置换出氢气,B错误;C. 铜的金属性强于银,银片插入硝酸铜溶液中不反应,C错误;D. 大理石与稀盐酸反应:CaCO3 + 2H+ =Ca2+ + CO2↑ + H2O,D正确,答案选D。

练习册系列答案
相关题目
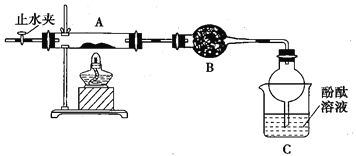
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
【题目】(题文)下列各选项有关对应有机物的说法正确的是( )
A |
| 最多有18个原子处在同一平面上 |
B |
| 主链上的碳原子数是5 |
C |
| 加氢后可以得到3-甲基戊烷 |
D |
| 的名称是1,3, 4-三甲基苯 |
A. A B. B C. C D. D