��Ŀ����
����Ŀ�������ѧ���������ɫ���������롣�Ѻ��д���CO2�Ŀ�������K2CO3��Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��H2��Ӧ���ɿ�������Դ�״����乤��������ͼ��ʾ��

��1���ֽ������Ҫ������_______________�����ѧʽ��
��2���ںϳ����У�����4400g CO2������H2��Ӧ��������̬��H2O�ͼ״����ɷų�5370kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ_______________________________________��
��3���ù�������������ɫ���������������ɫ������ķ�����_______________________(�δ�һ��)��
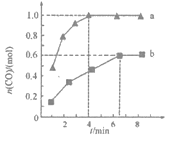
��4��һ�������£���2 L�����ܱ������г���1mol CO2��3mol H2���ڲ�ͬ���������·�����ӦI����ӦII�뷴ӦIII����ͬʱ����CO2��ת�������¶ȱ仯����ͼ��ʾ��

��ͼ��c���ת����Ϊ66.67%����ת����2/3��
�ٴ���Ч����ѵķ�Ӧ��_________��������ӦI��������ӦII��������ӦIII������ͬһ�ִ������¶�Խ�ߣ���Ч��____������������������ǿ����������������������ԭ�������_________������ĸ����
A���¶����ߣ�ƽ�������ƶ� B���¶����ߣ�����ʧ��
C���¶����ߣ������Ѹ������� D���¶����ߣ�ƽ�ⳣ����С
��b��v(��)______v(��)������>������<������=������
�����˷�Ӧ��a��ʱ�Ѵ�ƽ��״̬��a���ת���ʱ�c��ߵ�ԭ����__________��
��c��ʱ�÷�Ӧ��ƽ�ⳣ��K��______��
��5����ѧ�һ��о�������ת����������ķ�����������ͼ��ʾװ�ÿ��Խ�CO2ת��Ϊ����ȼ��CO����װ�ù���ʱ��N�缫�ĵ缫��ӦʽΪ___________________________����������ͨ������Ϊa mol����M���������Һ��H���ı���Ϊ________mol��

���𰸡� KHCO3 CO2(g)+3H2(g) = H2O(g)+CH3OH(g) ��H=-53.7 kJ/mol ���ٴ�����Ⱦ�����������Դ�״�����ѭ��ʹ�ã���������ѭ�����ã���̼���ö�����������ɫ�����������е�����ɫ�� ��ӦI ���� BC > �÷�Ӧ����Ӧ����Ϊ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ת���ʽ��� 5.33 L2mol-2 CO2+2e-+2H+=CO+H2O 0
����������1�����ճ���ʢ�б���̼�����Һ�����տ����еĶ�����̼��ת��ΪKHCO3����2��1mol������̼��Ӧ�ų�����Ϊ5370kJ��![]() =53.7kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��
=53.7kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H=-53.7KJ/mol����3�����ٴ����в����������Դ�״�����ѭ��ʹ�ã���������ѭ�����ã���̼���õȶ������ˡ���ɫ���ɡ������еġ���ɫ������4������ͼ��֪����Ӧ���ڽϵ��¶�T3ʱCO2�ʹﵽ80%��ת���ʣ�����Ч����ѵķ�Ӧ�Ƿ�Ӧ��T3��b��ʱ����Ӧδ�ﵽ�ȣ���v������>v���棩���۸÷�ӦΪ���ȷ�Ӧ��T4��Ӧ�Ѿ��ﵽƽ�⣬�����¶ȵ�T5ƽ�����淴Ӧ�ƶ����Ӷ�ʹCO2��ת���ʽ��ͣ�T4��a��ת���ʱ�T5��c��ߣ�
CH3OH��g��+H2O��g����H=-53.7KJ/mol����3�����ٴ����в����������Դ�״�����ѭ��ʹ�ã���������ѭ�����ã���̼���õȶ������ˡ���ɫ���ɡ������еġ���ɫ������4������ͼ��֪����Ӧ���ڽϵ��¶�T3ʱCO2�ʹﵽ80%��ת���ʣ�����Ч����ѵķ�Ӧ�Ƿ�Ӧ��T3��b��ʱ����Ӧδ�ﵽ�ȣ���v������>v���棩���۸÷�ӦΪ���ȷ�Ӧ��T4��Ӧ�Ѿ��ﵽƽ�⣬�����¶ȵ�T5ƽ�����淴Ӧ�ƶ����Ӷ�ʹCO2��ת���ʽ��ͣ�T4��a��ת���ʱ�T5��c��ߣ�
��c��ʱ�� CO2��g��+3H2��g��CH3OH��g��+H2O��g��
��ʼ��mol/L����0.6 1.8 0 0
ת����mol/L����0.6��![]() 0.6��2 0.6��
0.6��2 0.6��![]() 0.6��
0.6��![]()
ƽ�⣨mol/L����0.2 0.6 0.4 0.4
���¶�ΪT5ʱ���÷�Ӧ��ƽ�ⳣ��K=![]() =
=![]() =3.70����5����װ���У����ݵ�������֪��M�Ǹ�����N�������������õ��ӷ�����ԭ��Ӧ����ӦʽΪCO2+2e-+2H+=CO+H2O��M�缫��ӦʽΪ2H2O-4e-=O2��+4H+���ܷ�ӦʽΪ2CO2 =2CO+O2������������ͨ������Ϊa mol����M���������Һ��H���ı���Ϊ0mol��
=3.70����5����װ���У����ݵ�������֪��M�Ǹ�����N�������������õ��ӷ�����ԭ��Ӧ����ӦʽΪCO2+2e-+2H+=CO+H2O��M�缫��ӦʽΪ2H2O-4e-=O2��+4H+���ܷ�ӦʽΪ2CO2 =2CO+O2������������ͨ������Ϊa mol����M���������Һ��H���ı���Ϊ0mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�