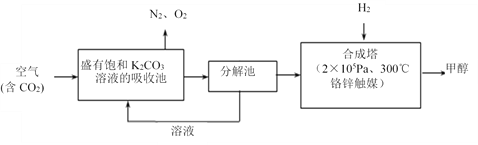
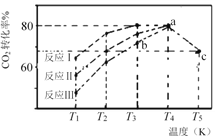
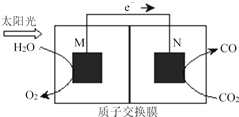
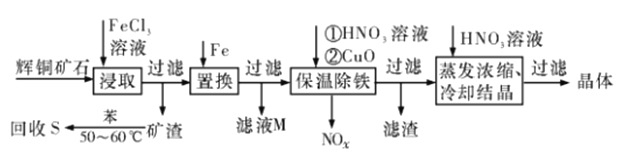
题目内容
【题目】工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
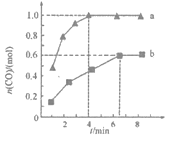
A. 容器a中CH4从反应开始到怡好平衡时的平均反应速率为0.025mol·L-1·min-1
B. a、b两容器的温度可能相同
C. 在达到平衡前,容器a的压强逐渐增大
D. 该反应在Ta温度下的平衡常数为27(mol·L-1)2
【答案】B
【解析】分析:观察两容器中CO的物质的量随时间的变化曲线a和b可知,当CO的物质的量保持不变时便达到平衡状态,a容器用了4min,b容器用了6.5min,两个容器中反应快慢不同,因此温度肯定不同。用三行式分析a容器中各物质的相关量:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始量(mol) 1.1 1.1 0 0
变化量(mol) 1 1 1 3
平衡量(mol) 0.1 0.1 1 3
详解:A. 容器a中CH4从反应开始到怡好平衡时的平均反应速率=![]() =
=![]() =0.025mol·L-1·min-1,故A正确;B. 根据以上分析a、b两容器的温度不可能相同,B错误;C. 因为该反应条件为等温等容,反应后气体的物质的量增大,所以在达到平衡前,容器a的压强逐渐增大,C正确;D. 该反应在Ta温度下的平衡常数=
=0.025mol·L-1·min-1,故A正确;B. 根据以上分析a、b两容器的温度不可能相同,B错误;C. 因为该反应条件为等温等容,反应后气体的物质的量增大,所以在达到平衡前,容器a的压强逐渐增大,C正确;D. 该反应在Ta温度下的平衡常数=![]() =
=![]() (mol·L-1)2=27(mol·L-1)2,D正确;因此本题答案为B。
(mol·L-1)2=27(mol·L-1)2,D正确;因此本题答案为B。

练习册系列答案
相关题目