题目内容
10.下列微粒属于等电子体的是( )| A. | 12CO2和14CO | B. | H2O和NH3 | C. | N2和13CO | D. | NO和CO |
分析 原子数总数相同、电子数目相同的微粒,互称为等电子体,据此分析.
解答 解:A.12CO2和14CO分子中原子数不同,所以不是等电子体,故A错误;
B.H2O和NH3分子中中原子数不同,所以不是等电子体,故B错误;
C.N2和13CO分子中都含有2个原子,电子总数分别为14、14,所以是等电子体,故C正确;
D.NO和CO分子中都含有2个原子,电子总数分别为15、14,所以不是等电子体,故D错误.
故选C.
点评 本题考查了等电子体的判断,根据等电子体的概念来分析解答即可,难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
18.有一种MCFC型氢氧燃料电池,电解质为熔融的K2CO3.电池的总反应为:2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2.下列说法中正确的( )
| A. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| D. | 电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路 |
5.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
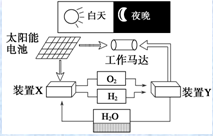

| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该系统中只存在3种形式的能量转化 | |
| D. | 装置X、Y形成的子系统能实现物质零排放,并能实现化学能与电能间的完全转化 |
2.一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24L(标准状况下),则下列情况不可能的是( )
| A. | 加入Cu的质量为6.4g | B. | 加入Cu的质量大于6.4g | ||
| C. | 加入浓H2SO4中含溶质为0.2mol | D. | 加入浓H2SO4中含溶质大于0.2mol |
19.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题.
(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
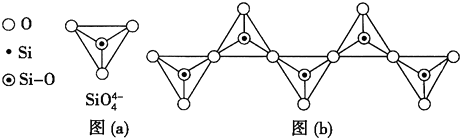
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.
(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能 (kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

20.要想除去丙烷中的乙烯并得到纯净的丙烷,可选择的试剂是( )
| A. | NaOH 溶液、浓H2SO4 | B. | 溴的四氯化碳溶液、浓H2SO4 | ||
| C. | 乙醇、浓H2SO4 | D. | 酸性高锰酸钾溶液、浓H2SO4 |
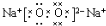 .
.