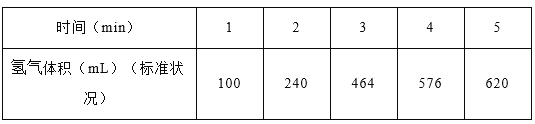
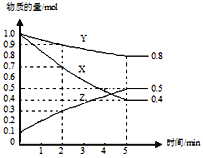
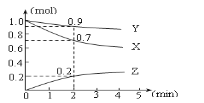
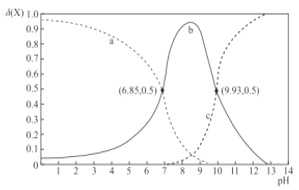
题目内容
【题目】某小组使用下图装置制取并收集干燥、纯净的氯气,请回答问题:
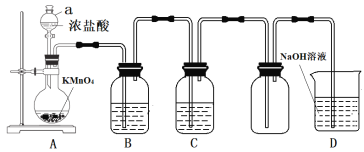
(1)A装置中仪器a的名称是__________,KMnO4的作用_____________________
(2)C装置盛放的试剂是_______________,其作用是____________________
(3)写出D装置中反应的离子方程式__________________________
【答案】分液漏斗 作氧化剂 浓硫酸 干燥氯气 Cl2+2OH-=== Cl-+ClO-+H2O
【解析】
高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气、水,浓盐酸为易挥发性酸,若要收集干燥、纯净的氯气,需要去除HCl、水,因氯气会污染环境以及具有毒性,因此需要用NaOH溶液吸收多余的Cl2,据此分析本题。
(1)a为分液漏斗;在反应过程中,Cl元素化合价升高,因此KMnO4的作用是作氧化剂;
故答案为:分液漏斗;作氧化剂;
(2)由上述分析可知,B中试剂为饱和食盐水,目的是去除氯气中氯化氢气体,装置C的目的是干燥气体,因此C中所装试剂为浓硫酸;
故答案为:浓硫酸;干燥氯气;
(3)氯气与NaOH溶液反应生成氯化钠、次氯酸钠,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目