题目内容
16.某化合物2.3g在足量的氧气中充分燃烧,只生成了4.4g CO2和2.7gH2O.该化合物的相对分子质量是氢气相对分子质量的23倍.该化合物的分子式为C2H6O;若该化合物的1H核磁共振谱只有一个信号峰,则其结构简式为CH3CH2OH.分析 根据2.3g该有机物充分燃烧生成的二氧化碳、水的量判断有机物A中的碳元素、氢元素的物质的量、质量,再判断是否含有氧元素,再计算出C、H、O元素的物质的量之比,最后结合核磁共振氢谱判断该有机物分子的结构简式.
解答 解:2.3 g该有机物中,n(C)=n(CO2)=0.1 mol,含有的碳原子的质量为m(C)=0.1 mol×12 g•mol-1=1.2 g,
氢原子的物质的量为:n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,氢原子的质量为m(H)=0.3 mol×1 g•mol-1=0.3 g,
该有机物中m(O)=2.3 g-1.2 g-0.3 g=0.8 g,氧元素的物质的量为n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,
则n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是C2H6O,因为实验式是C2H6O的有机物中,氢原子数已经达到饱和,所以其实验式即为分子式;
A有如下两种可能的结构:CH3OCH3或CH3CH2OH;若为前者,则在核磁共振氢谱中应只有1个峰;若为后者,则在核磁共振氢谱中应有3个峰,而且3个峰的面积之比是1:2:3,显然CH3CH2OH符合题意,所以A为乙醇,
故答案为:C2H6O;CH3CH2OH.
点评 本题考查了有机物分子式、结构简式的计算方法,题目难度中等,注意根据质量守恒确定有机物分子式的方法,明确质量比的含义是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列现象与电化学腐蚀无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| C. | 铁质器件附有铜质配件,接触处容易生铁锈 | |
| D. | 银质奖牌放置久了表面变暗 |
1.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 在离子晶体里,只存在离子键 | |
| B. | 共价化合物里,一定不存在离子键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 由不同种元素组成的多原子分子里,一定只有极性键 |
8.下面是人们对于化学科学的各种常见的认识,其中错误的是( )
| A. | 化学将为环境、能源、资源等问题的解决提供有力保障 | |
| B. | 化学正发展成为一门实验与理论互相结合、互相渗透的科学 | |
| C. | 化学是一门具有极强实用性的自然科学 | |
| D. | 化学是一门纯实验的自然科学,实验是探究化学过程的唯一途径 |
5.关于下列图示装置运用的叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.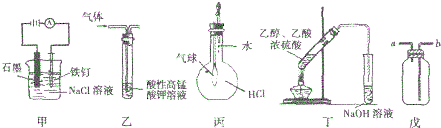
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
6.下列关于范德华力影响物质性质的叙述中,正确的是( )
| A. | 范德华力是决定由分子构成物质熔、沸点高低的惟一因素 | |
| B. | 范德华力与物质的性质没有必然的联系 | |
| C. | 范德华力能够影响物质的化学性质和物理性质 | |
| D. | 范德华力仅是影响物质部分物理性质的一种因素 |
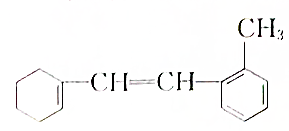 :
: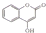 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
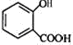 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$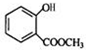 +H2O.
+H2O.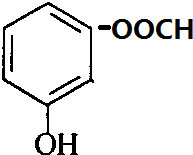 、
、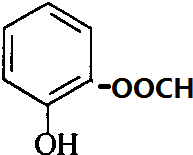 、
、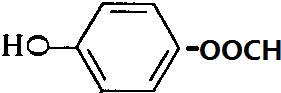 .
.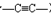 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )