题目内容
4.下列现象与电化学腐蚀无关的是( )| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| C. | 铁质器件附有铜质配件,接触处容易生铁锈 | |
| D. | 银质奖牌放置久了表面变暗 |
分析 A、铜锌合金在电解质溶液中形成原电池反应,依据原电池电极反应分析判断;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极;
D、银在空气中被氧化发生化学腐蚀.
解答 解:A、铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿;和电化学有关,故A不符合;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极发生氧化反应被腐蚀;所以容易生锈,故B不符合;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,故C不符合;
D、银在空气中被氧化发生化学腐蚀;和电化腐蚀无关,故D符合;
故选D.
点评 本题考查了化学腐蚀和电化腐蚀的实质分析,原电池的形成条件是解题关键,题目较简单.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
9.下列各选项中,原因、结论及因果关系均正确的是( )
| A. | 因为H-F的键能大于H-CI,所以HF的沸点高于HCI | |
| B. | 因为HCIO4比HCIO中的氯元素的化合价高,所以HCIO4的氧化性强于HCIO | |
| C. | 因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3 | |
| D. | 因为Fe的还原性强于Cu,所以Cu2+的氧化性强于Fe3+ |
15.同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
12.下列叙述中能肯定A金属比B金属活泼性强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多 | |
| D. | 常温时,A能从水中置换出氢,而B不能 |
19.将3.84g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗酸的物质的量是( )
| A. | 0.11mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
9.现有某化学式为C3H6O3的有机物,其1H核磁共振谱有三个峰,强度之比为3:2:1,则该有机物的结构简式不可能为( )
| A. | CH3CH2COOH | B. | HCOOCH2CH3 | C. | CH3COOCH3 | D. | CH3COCH2OH |
13.在检验SO42-的过程中,下列操作中正确的是( )
| A. | 先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存 |
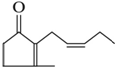 有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
有机化合物A是人工合成的香料茉莉酮,其结构简式如图: