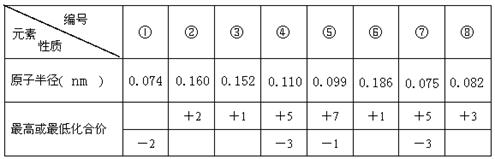
题目内容
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S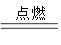 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
① 除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________ ,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
2KNO3+ 3C+S
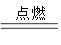 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)① 除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________ ,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
(7分) (1)①O>N>C>K ②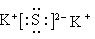 ; sp ③1:1
; sp ③1:1
(2)3d84s2; 4 【(2)第一个空2分,其余每空1分】
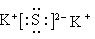 ; sp ③1:1
; sp ③1:1(2)3d84s2; 4 【(2)第一个空2分,其余每空1分】
试题分析:(1)①非金属性越强,电负性越大,所以电负性强弱顺序是O>N>C>K。
②根据原子守恒可知,A应该是硫化钾,含有离子键的离子化合物,电子式是
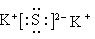 。含极性共价键的分子是CO2,属于直线型结构,则中心原子轨道杂化类型sp杂化。
。含极性共价键的分子是CO2,属于直线型结构,则中心原子轨道杂化类型sp杂化。②CN-与N2结构相似,则该化合物中碳元素和氮元素之间是三键。由于三键是由1个σ键与2个π键构成,而单键都是σ键,因此HCN分子中σ键与π键数目之比为1:1。
(2)在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,则一定是第Ⅷ族,是由T是镍,Q是铁元素。则根据构造原理可知,镍元素的基态原子外围电子(价电子)排布式为3d84s2,亚铁离子的未成对电子数是4。
点评:该题是中等难度的试题,试题基础性强,难易适中,贴近高考。在注重对基础知识考查与巩固的同时,主要是侧重对学生解题能力与技巧的培养和训练,有利于培养学生的灵活运用基础知识解决实际问题的能力,也有助于提高学生的创新思维能力和学习效率。

练习册系列答案
相关题目
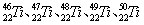 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为 和
和