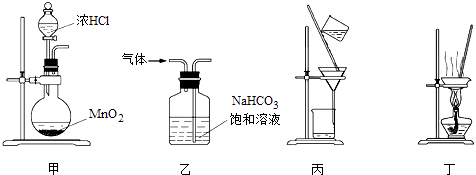
题目内容
【题目】现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl、SO42、AlO2、OH中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,回答下列问题:
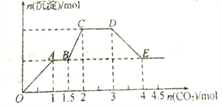
(1)该溶液中能确定存在的离子是____________________;
(2) 肯定不存在的离子是___________;
(3) 若不能确定的离子中至少还存在一种阳离子,检验该阳离子的方法是____________;
则该离子的浓度为 _________;
(4)CD段反应的离子方程式__________________________________________。
【答案】 Ba2+、OH、AlO2 SO42、NH4+ 焰色反应 ≥0.2mol/L CO2+CO32-+H2O=2HCO3-
【解析】通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+、OH-,根据离子共存条件,一定不含SO42-,因二者反应会生成硫酸钡沉淀;在BC段产生沉淀,说明含AlO2-,AlO2-存在碱性环境,故一定含OH-,不含NH4+,因两者反应放出氨气,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含OH-共2.5mol,根据BC段可知发生反应:2 AlO2-+CO2+3H2O═2A l(OH)3↓+CO32-,故消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应为碳酸根离子转化为碳酸氢根离子,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带:2mol,阴离子所带负电荷为AlO2-、OH-所带:2.5mol+1mol=3.5mol,故一定还含阳离子.
(1)根据以上分析,一定含Ba2+、AlO2-、OH-,一定不含:NH4+、Cl-、SO42;不能确定离子中至少还存在一种阳离子存在,所给阳离子中还有K+、Na+没确定,可通过焰色反应来鉴别;根据电荷守恒,所含离子的物质的量设为n,则有:n+2mol=4mol,n=2mol,浓度为:2.0mol/10L=0.2mol/L,若含氯离子,则阳离子浓度大于0.2mol/L;故答案为:(1)Ba2+、OH、AlO2;(2)NH4+、SO42;(3)焰色反应;≥0.2mol/L;(4)CD段反应的离子方程式:CO2+CO32-+H2O=2HCO3-

 阅读快车系列答案
阅读快车系列答案【题目】图为元素周期表的一部分,请根据元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 .
(2)④、⑤、⑥的简单离子半径由大到小的顺序是(用离子符号
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: .
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族);
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A ![]() B
B ![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为 .
对应的反应①的离子方程式为 .