题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)①将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应产生的气体最多.
②向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律 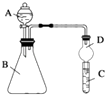
③仪器B的名称为 , 干燥管D的作用为 .
④若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
⑤若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液的现象,即可证明.
【答案】
(1)钾;铝;S2﹣+Cl2═S↓+2Cl﹣
(2)锥形瓶;防止倒吸;溶液变蓝色;NaOH;硝酸;硅酸钠;产生白色沉淀
【解析】解:(1)①金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,
所以答案是:钾;铝; ②氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2﹣+Cl2═S↓+2Cl﹣ ,
所以答案是:S2﹣+Cl2═S↓+2Cl﹣ .
·(2)③仪器B的名称为锥形瓶;尾气处理装置中,有缓冲装置的能防止倒吸,干燥管有缓冲作用,所以能防止倒吸,
所以答案是:锥形瓶;防止倒吸;④浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成Cl2 , Cl2具有氧化性,能氧化I﹣生成I2 , 碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;Cl2和碱反应生成盐,可以用碱液吸收氯气,如NaOH溶液,
所以答案是:溶液变蓝色;NaOH;⑤非金属的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,若要证明非金属性:N>C>Si,只要证明硝酸酸性大于碳酸,碳酸酸性大于硅酸即可,所以A中加入硝酸溶液,B中加碳酸钙、C中加入Na2SiO3;当硅酸钠溶液中产生白色沉淀说明生成硅酸.
所以答案是:硝酸;硅酸钠;产生白色沉淀.
【考点精析】利用非金属在元素周期表中的位置及其性质递变的规律对题目进行判断即可得到答案,需要熟知在目前已知的112种元素中,非金属元素有22种,除H外非金属元素都位于周期表的右上方(H在左上方).F是非金属性最强的元素.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】图为元素周期表的一部分,请根据元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 .
(2)④、⑤、⑥的简单离子半径由大到小的顺序是(用离子符号
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: .
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族);
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A ![]() B
B ![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为 .
对应的反应①的离子方程式为 .