题目内容
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3 . 请回答下列问题:
(1)Na3N的电子式是 , 该化合物由键形成.
(2)Na3N与盐酸反应生成种盐,其电子式分别是 , .
(3)Na3N与水的反应属于(填基本反应类型)反应.
(4)比较Na3N中两种粒子的半径:r(Na+)(填“>”“=”“<”) r(N3﹣).
【答案】
(1)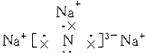 ;离子
;离子
(2)2;![]() ;
;![]()
(3)复分解
(4)<
【解析】解:(1)氮化钠是由钠离子与氮离子通过离子键结合成的离子化合物,电子式为 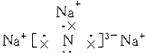 ,所以答案是:
,所以答案是: 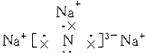 ;离子;
;离子;
(2.)Na3N与盐酸反应生成氯化钠和氯化铵,方程式Na3N+4HCl=3NaCl+NH4Cl,氯化钠为离子化合物,电子式为: ![]() ;氯化铵为离子化合物,电子式:
;氯化铵为离子化合物,电子式: ![]() ;
;
所以答案是:2; ![]() ;
; ![]() ;
;
(3.)Na3N电离出Na+、N3﹣ , H2O电离出H+、OH﹣ , N3﹣和H+结合成为NH3 , Na+与OH﹣结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
所以答案是:复分解;
(4.)钠离子与氮离子具有相同的核外电子排布,钠离子质子数多与氮离子,所以钠离子半径小于氮离子,所以答案是:<.

练习册系列答案
相关题目
