题目内容
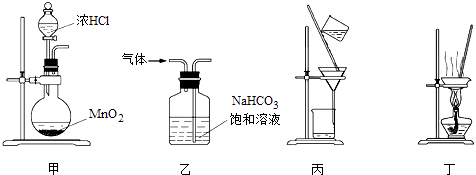
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1所示。由图中可以看出,该同学在操作时的一个错误是___________________,烧杯的实际质量为__________ g。
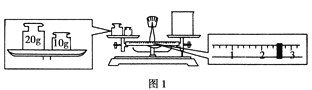
(2)需配制150 mL 0.2 mol·L-1 NaCl溶液,该同学转移溶液的示意图如图2所示。指出实验中存在的两个错误:_________________________________。
(3)用质量分数为98%密度为1.84 g·cm-3的浓硫酸配制1 000 mL 0.1 mol·L-1的稀硫酸。
①应用量筒量取浓硫酸________ mL;
②配制硫酸时需用到的仪器有量筒、小烧杯、玻璃棒、_______________________;
③下列操作使所配制溶液的物质的量浓度偏高的是________(填序号)。
A.称量时用了生锈的砝码 B.将NaOH放在纸张上称量
C.定容时俯视刻度线 D.往容量瓶中转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯 F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
【答案】 物质与砝码放反了 27.4g 没有用玻璃棒引流;容量瓶容积选错 5.4 1000mL容量瓶,胶头滴管 A、C
【解析】(1)天平称量物体时遵循左物右码的原则,在该实验图中可以看出,该同学在操作时的一个错误是砝码与烧杯放反了位置,根据天平平衡原理:左盘物体质量=右盘砝码质量+游码质量,若果放反了,则左盘砝码质量=右盘物体质量+游码质量,所以右盘物体质量=左盘砝码质量-游码质量=30g-2.6g=27.4g;(2)根据装置图可知,共有两处错误,分别是①没有用玻璃棒引流;②容量瓶规格错误,没有用150mL容量瓶;;(3)①浓H2SO4的物质的量浓度c=![]() mol/L=18.4 mol/L;根据稀释定律,稀释前后溶质的物质的量不变来计算浓硫酸的体积,设浓硫酸的体积为x mL,则有:x mL×18.4 mol/L=1000 mL×0.1 mol/L,解得:x≈5.4;②步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤2~3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加,最后定容颠倒摇匀。由提供的仪器可知还需要仪器有玻璃棒、烧杯、1000 mL容量瓶、胶头滴管;③A、生锈的砝码质量偏大,而m物=m砝+m游,故称量出的药品的质量偏重,则配制出的溶液的浓度偏大,选项A正确;B、将NaOH放在纸张上称量会潮解,导致真正称得的NaOH的质量偏小,则配制出的溶液的浓度偏小,选项B错误;C、定容时俯视刻度线,溶液体积偏小,则浓度偏大,选项C正确;D、往容量瓶转移时,有少量液体溅出,会导致溶质的损失,则溶液浓度偏小,选项D错误;E、未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小,选项E错误;F、定容时仰视刻度线,会导致溶液体积偏大,则浓度偏小,选项F错误;G、只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,选项G错误;H、定容后塞上瓶塞反复摇匀,静臵后,液面不到刻度线是正常的,再加水至刻度线导致浓度偏小,选项H错误。答案选AC。
mol/L=18.4 mol/L;根据稀释定律,稀释前后溶质的物质的量不变来计算浓硫酸的体积,设浓硫酸的体积为x mL,则有:x mL×18.4 mol/L=1000 mL×0.1 mol/L,解得:x≈5.4;②步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤2~3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加,最后定容颠倒摇匀。由提供的仪器可知还需要仪器有玻璃棒、烧杯、1000 mL容量瓶、胶头滴管;③A、生锈的砝码质量偏大,而m物=m砝+m游,故称量出的药品的质量偏重,则配制出的溶液的浓度偏大,选项A正确;B、将NaOH放在纸张上称量会潮解,导致真正称得的NaOH的质量偏小,则配制出的溶液的浓度偏小,选项B错误;C、定容时俯视刻度线,溶液体积偏小,则浓度偏大,选项C正确;D、往容量瓶转移时,有少量液体溅出,会导致溶质的损失,则溶液浓度偏小,选项D错误;E、未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小,选项E错误;F、定容时仰视刻度线,会导致溶液体积偏大,则浓度偏小,选项F错误;G、只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,选项G错误;H、定容后塞上瓶塞反复摇匀,静臵后,液面不到刻度线是正常的,再加水至刻度线导致浓度偏小,选项H错误。答案选AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案