题目内容
4.完全中和66mL HCl的质量分数为20%的稀盐酸(密度为1.1g•cm-3),需要NaOH的物质的量是0.398mol.若改用Ca(OH)2则需要0.199mol.分析 根据c=1000ρωM计算盐酸的物质的量浓度,根据n=cV计算HCl物质的量,再根据方程式计算需要NaOH、Ca(OH)2的物质的量.
解答 解:根据c=1000ρωM可知,该盐酸的物质的量浓度为1000×1.1×2036.5mol/L≈6.03mol/L,故HCl物质的量为6.03mol/L×0.066L=0.398mol,
由NaOH+HCl=NaCl+H2O,可知n(NaOH)=n(HCl)=0.398mol;
由Ca(OH)2+2HCl=NaCl+2H2O,可知n[Ca(OH)2]=12n(HCl)=12×0.398mol=0.199mol,
故答案为:0.398;0.199.
点评 本题考查溶液浓度计算、化学方程式计算,比较基础,注意对物质的量浓度定义理解,掌握物质的量浓度与质量分数之间关系.

练习册系列答案
相关题目
14.化学在生产和日常生活中有着重要的作用,下列叙述正确的是( )
| A. | 氧化铝的熔点很低,不能用于制作耐高温材料 | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 无水乙醇用作医用消毒剂效果更好 | |
| D. | Na、S、C分别在氧气中点燃均可得到两种不同的氧化物 |
12.下列说法不正确的是( )
| A. | 标准状况下,11.2LCO2的质量为22g | |
| B. | 0.1molCl2与足量水反应转移电子0.2mol | |
| C. | 18gH2O含有的原子总数为3×6.02×1023 | |
| D. | 0.5mol/L Na2SO3溶液中Na+的物质的量浓度为1.0 mol/L |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6g铁与足量稀硫酸反应转移的电子数为0.3NA | |
| B. | 标准状况下,11.2L水中含有分子的数目为0.5NA | |
| C. | 500 mL 0.2 mol•L-1 CaCl2溶液中氯离子数目为 0.1NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
9.实验室制备Al(OH)3最好用( )
| A. | Al和水 | B. | Al2O3和水 | C. | Al2(SO4)3和KOH | D. | AlCl3和氨水 |
5.下列四个选项是在不同的情况下对化学反应3A(g)+B(g)?2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | v(D)=0.5mol•L-1.s-1 | B. | v(C)=3.0 mol•L-1•min-1 | ||
| C. | v(B)=0.30 mol•L-1.s-1 | D. | v(A)=0.60 mol•L-1.s-1 |
2.下列有机物的命名正确的是( )
| A. |  2-乙基丙烷 | B. | 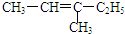 3-甲基-3-戊烯 | C. | 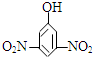 2,4-二硝基苯酚 | D. | 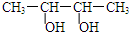 2,3-丁二醇 |
3.下列各对物质中属于同分异构体的是( )
| A. | O2与O3 | B. | CH3CH2OH与CH3CH2-O-CH2CH3 | ||
| C. | 126C与136C | D. | CH3CH2CH2CH3与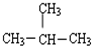 |