题目内容
15.质量为10g的镁铝合金,与200mL 0.5mol•L-1的氢氧化钠溶液恰好完全反应.已知铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+6H2O═2Na[Al(OH)4]+3H2↑求:(1)合金中铝的质量分数
(2)生成气体在标准状况下的体积.
分析 铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,但是金属镁和氢氧化钠之间不会发生反应,根据反应的方程式结合氢氧化钠物质的量进行进行计算即可.
解答 解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,镁不与氢氧化钠溶液反应,
200mL 0.5mol•L-1的氢氧化钠溶液中含有NaOH的物质的量为:0.5mol/L×0.2L=0.1mol,
设合金中金属铝的物质的量是n,
2Al+2NaOH+6H2O═2Na[Al(OH)4]+3H2↑
2 2 3
n 0.1mol x
则:n=0.1mol×220.1mol×22=0.1mol,金属铝的质量为:27g/mol×0.1mol=2.7g,合金中铝的质量分数为:2.7g10g2.7g10g×100%=27%,
答:合金中铝的质量分数为27%;
(2)设生成标况下氢气的体积为x;
2Al+2NaOH+6H2O═2Na[Al(OH)4]+3H2↑
2mol 3×22.4L
0.1mol x
则:x=3×22.4L×0.1mol2mol3×22.4L×0.1mol2mol,
解得:x=3.36L,
答:生成气体在标准状况下的体积是3.36L.
点评 本题考查混合物反应的计算,题目难度中等,明确计算镁和铝的化学性质为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等物理量之间的转化关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列关于胶体的认识错误的是( )
| A. | 提纯胶体可采用渗析的方法 | |
| B. | 用丁达尔效应可以区别溶液和胶体 | |
| C. | 往氯化铁溶液中滴加少量氢氧化钠溶液可制得氢氧化铁胶体 | |
| D. | 加热可使胶体发生聚沉 |
3.有机化合物苯酚的试剂瓶上有如下标识:上述标识的含义是( )
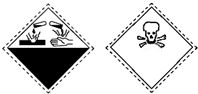

| A. | 自燃物品、易燃 | B. | 氧化剂、剧毒 | C. | 爆炸性、腐蚀性 | D. | 腐蚀性、剧毒 |
10.下列说法不正确的是( )
| A. | 盛有浓H2SO4 的烧杯在空气中敞口放置一段时间后,质量增加 | |
| B. | SO2 溶于水能导电,所以SO2 是电解质 | |
| C. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内的氨水物质的量浓度为122.4122.4 mol/L | |
| D. | 用蘸占有稀氨水的毛笔,在浸有酚酞溶液的滤纸上写出的字呈红色 |
20.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,22.4 L氢气含有的氢分子数为NA | |
| B. | 常温常压下,18 g水含有的原子数为3NA | |
| C. | 23g Na在氧气中完全燃烧转移的电子数为 2NA | |
| D. | 0.3 mol/LNa2SO4溶液中含有Na+的数目为0.6NA |
7.下列关于Na2O2的说法中,不正确的是( )
| A. | 浅黄色固体 | B. | 可用作供氧剂 | ||
| C. | 与H2O反应时,H2O作还原剂 | D. | 与H2O反应时,放出热量 |
14.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
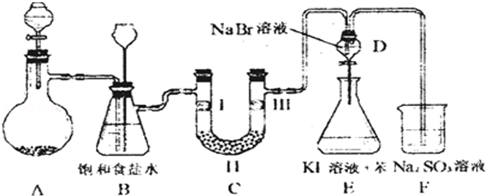
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯的非金属性大于溴.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).