题目内容
12.下列说法不正确的是( )| A. | 标准状况下,11.2LCO2的质量为22g | |
| B. | 0.1molCl2与足量水反应转移电子0.2mol | |
| C. | 18gH2O含有的原子总数为3×6.02×1023 | |
| D. | 0.5mol/L Na2SO3溶液中Na+的物质的量浓度为1.0 mol/L |
分析 A.根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,再根据m=nM计算其质量;
B.发生反应:Cl2+H2O=HCl+HClO,反应中氯气气起氧化剂、还原剂作用,各占一半,结合Cl元素化合价变化计算转移电子;
C.根据n=$\frac{m}{M}$计算水的物质的量,根据N=nNA计算水分子数目,含有原子数目为水分子的3倍;
D.钠离子浓度为亚硫酸钠的2倍.
解答 解:A.标准状况下,11.2LCO2的质量为$\frac{11.2L}{22.4L/mol}$×44g/mol=22g,故A正确;
B.发生反应:Cl2+H2O=HCl+HClO,反应中氯气气起氧化剂、还原剂作用,各占一半,Cl元素化合价由30价变为+1价、-1价,故转移电子为0.1mol×$\frac{1}{2}$×2=0.1mol,故B错误;
C.18gH2O的物质的量为1mol,含有水分子数目为6.02×1023,则含有的原子总数为3×6.02×1023,故C正确;
D.0.5mol/L Na2SO3溶液中Na+的物质的量浓度为0.5mol/L×2=1.0 mol/L,故D正确,
故选B.
点评 本题考查物质的量有关计算,比较基础,B中注意根据方程式判断氯气在反应中的作用.

练习册系列答案
相关题目
2.根据下表中的信息回答问题:
(1)B的原子结构示意图为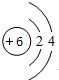 ,物质X的化学式为SiO2
,物质X的化学式为SiO2
(2)C、D、F三种元素对应的氢化物稳定性大小顺序是H2O>NH3>SiH4(填化学式)
(3)A、D、E三种元素形成的化合物中存在的化学键类型是离子键、共价键
(4)有两种盐,它们均由A、D、E、G四种元素组成,二者在溶液中反应的离子方程式是H++HSO3-=SO2↑+H2O
(5)B、F两元素中非金属性较强的是碳(写出元素名称),请设计一个简单的实验证明这一结论取硅酸钠溶液于试管中,向其中通入二氧化碳气体,观察是否有白色沉淀产生.
| Ⅰ | A、B、C、D、E、F、G七种短周期元素的原子序数依次增大 |
| Ⅱ | A和E同主族,B和F同主族,D和G同主族 |
| Ⅲ | A原子核内只有质子没有中子,B原子最外层电子数是电子层数的2倍 |
| Ⅳ | D和F以原子个数比为2:1组成的物质X是光导纤维的主要成分 |
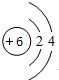 ,物质X的化学式为SiO2
,物质X的化学式为SiO2(2)C、D、F三种元素对应的氢化物稳定性大小顺序是H2O>NH3>SiH4(填化学式)
(3)A、D、E三种元素形成的化合物中存在的化学键类型是离子键、共价键
(4)有两种盐,它们均由A、D、E、G四种元素组成,二者在溶液中反应的离子方程式是H++HSO3-=SO2↑+H2O
(5)B、F两元素中非金属性较强的是碳(写出元素名称),请设计一个简单的实验证明这一结论取硅酸钠溶液于试管中,向其中通入二氧化碳气体,观察是否有白色沉淀产生.
3.有机化合物苯酚的试剂瓶上有如下标识:上述标识的含义是( )
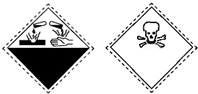

| A. | 自燃物品、易燃 | B. | 氧化剂、剧毒 | C. | 爆炸性、腐蚀性 | D. | 腐蚀性、剧毒 |
20.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,22.4 L氢气含有的氢分子数为NA | |
| B. | 常温常压下,18 g水含有的原子数为3NA | |
| C. | 23g Na在氧气中完全燃烧转移的电子数为 2NA | |
| D. | 0.3 mol/LNa2SO4溶液中含有Na+的数目为0.6NA |
7.下列关于Na2O2的说法中,不正确的是( )
| A. | 浅黄色固体 | B. | 可用作供氧剂 | ||
| C. | 与H2O反应时,H2O作还原剂 | D. | 与H2O反应时,放出热量 |
17.下列反应的离子方程式书写正确的是( )
| A. | 向稀硫酸中加入氢氧化钡溶液:OH-+H+═H2O | |
| B. | 铜与稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向氯化铁溶液中加入过量铜:Fe3++Cu═Fe+Cu2+ |
10.若NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在25℃,101kPa时,22.4L氢气中含有2NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
11.在元素周期表中前18号元素中,其原子的最外层电子数是最内层电子数2k倍的(k为正整数)共有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |