题目内容
【题目】已知反应:2NO2(红棕色) ![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
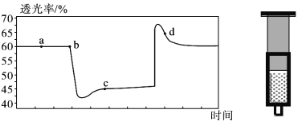
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
【答案】A
【解析】
该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但c(NO2)增大,混合气体颜色变深;压强减小平衡逆向移动,但c(NO2)减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大。
A.b点开始是压缩注射器的过程,c(NO2)增大,气体颜色变深,透光率变小,A正确;
B.d点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v正<v逆,B错误;
C.c点是压缩注射器后的情况,c(NO2)和c(N2O4)均增大,C错误;
D.b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致Tb<Tc,D错误;
答案选A。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】如表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
W | X | Y |
Z |
(1)Z的元素符号是________,原子结构示意图是_________。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为_________。
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 | ____ | ____ |
2 | ____ | ____ |