题目内容
【题目】某同学用不同方法制得白色的Fe(OH)2沉淀。
(1)用未被氧化的FeSO4溶液与煮沸过的蒸馏水配制的NaOH溶液反应制备,制备过程中下列说法正确的是_______
A.用硫酸亚铁晶体配制上述FeSO4溶液时还需加入适量盐酸防止水解
B.除去蒸馏水中溶解的O2也可以采取振摇、静止的方法
C.生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液
D.FeSO4溶液上面加一层苯可以防止空气中氧气直接与溶液接触
(2)在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。在试管I 里加入稀H2SO4和铁屑,在试管II里加入NaOH溶液,打开止水夹,塞紧塞子,检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯浄时,再____(填操作步骤),这样一段时间后试管Ⅲ中制得的Fe(OH)2沉淀能较长时间保持白色,其理由是__________________。
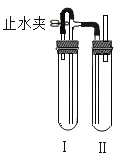
【答案】CD 夹紧止水夹试管 试管I和试管II充满了H2,且外界空气不容易进入
【解析】
(1)A.配制溶液时不能引入新的杂质;
B.摇动会增大O2在蒸馏水中的溶解度;
C.制取白色Fe(OH)2沉淀,要防止O2与制取Fe(OH)2的溶液接触;
D.苯密度比水小,覆盖在溶液液面上,可以防止空气中氧气直接与溶液接触;
(2)Fe与稀硫酸反应产生H2,H2通过导气管进入试管II,将试管II中溶液中的空气排出后,关闭止水夹,试管I中产生的FeSO4溶液进入试管II中,与II中NaOH反应产生Fe(OH)2沉淀,由于装置内无O2,因此可以较长时间观察到白色沉淀。
(1) A.用硫酸亚铁晶体配制上述FeSO4溶液时,FeSO4发生水解反应:FeSO4+2H2O![]() Fe(OH)2+H2SO4,为了抑制盐的水解,要加入酸,同时不能引入杂质离子,所以应该加入适量稀H2SO4,不能加入盐酸,A错误;
Fe(OH)2+H2SO4,为了抑制盐的水解,要加入酸,同时不能引入杂质离子,所以应该加入适量稀H2SO4,不能加入盐酸,A错误;
B.蒸馏水中溶解的O2若采取振摇、静止的方法,就会增大O2与蒸馏水的接触面积,不仅不能除去O2,反而会增大O2的溶解度,B错误;
C.用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,会发生反应:FeSO4+2NaOH= Fe(OH)2↓+Na2SO4,由于装置中避免了与O2的接触,因此可以较长时间观察到白色沉淀,C正确;
D.苯的密度比水小,难溶于水,覆盖在FeSO4溶液上面,就可以防止空气中氧气直接与溶液接触,因此可以制取得到Fe(OH)2白色沉淀,D正确;
故合理选项CD;
(2)在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备Fe(OH)2。在试管I 里加入稀H2SO4和铁屑,Fe与稀硫酸反应产生氢气和FeSO4,反应产生的氢气通过导气管进入到试管II里,将NaOH溶液及溶液上部空间的空气排出,使NaOH溶液周围充满了氢气当排出的H2纯浄时,再夹紧止水夹,试管I中反应产生的氢气使I中气体压强增大,将FeSO4溶液压入到试管II中,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,由于试管I和试管II整个装置中都充满了H2,且外界空气不容易进入装置内,所以制得的Fe(OH)2沉淀能较长时间保持白色。








