题目内容
18.重水(D2O)是重要的核工业原料,下列说法错误的是( )| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
分析 A.相同元素组成,不同形态的单质互为同素异形体;
B.具有相同质子数、不同中子数的原子互为同位素;
C.氘(D)质子数为1,质子数=核外电子数;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20.
解答 解:A.H2O与D2O均为水,属于化合物,不互为同素异形体,故A错误;
B.1H与D质子数都是1,中子数分别为0、1,互称同位素,故B正确;
C.氘(D)质子数为1,质子数=核外电子数,故原子核外有1个电子,故C正确;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故D正确,
故选A.
点评 本题考查同素异形体及同位素,把握相关的概念及核变化为解答的关键,选项D为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
8.下列变化需克服相同类型作用力的是( )
| A. | 溴和汞的气化 | B. | 二氧化硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 碘和干冰的升华 |
9.在一定条件下,对于在密闭容器中进行的反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
| A. | 达到化学平衡时,v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成2mol NO的同时消耗2 molNH3 | |
| C. | NH3、O2、NO、H2O在容器中共存 | |
| D. | c(NH3)保持不变 |
13.下列分离提纯的方法正确的是( )
| A. | 用酒精提取碘水中的碘 | |
| B. | 重结晶法除去硝酸钾中的氯化钠 | |
| C. | 蒸馏法分离乙醇和苯酚 | |
| D. | 除去乙烷中少量的乙烯,方法是在光照条件下通氯气 |
3.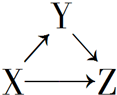 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )
①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
7.在元素周期表中有很多的规律与特点,下列说法不正确的是( )
| A. | 两种不同的元素不可能既在同一周期,又在同一主族 | |
| B. | 元素周期表中的元素不全是从自然界中发现的 | |
| C. | 周期表中共1-20号元素,含有非金属11种 | |
| D. | 若周期表中第8周期完全填满,此周期应含有有50种元素 |
14.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
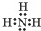 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.