题目内容
20.下列图示与对应的叙述相符的是( )
| A. | 由图甲可以判断:对于反应a A (g)+b B (g)?cC (g),若T1>T2,则a+b=c,且△H<0 | |
| B. | 图乙表示温度对可逆反应2A (g)+2 B (g)?3C (g)+D (g)的影响,甲的温度比乙的温度高且正反应为吸热 | |
| C. | 图丙表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 图丁表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 |
分析 A.升高温度,平衡向吸热反应方向移动,压强改变反应前后气体计量数之和不变的反应的移动;
B.温度越高,反应速率越快,则反应达到平衡时间越短;升高温度平衡向吸热反应方向移动;
C.根据浓度与温度的关系知,升高温度,平衡向逆反应方向移动,D点未达到平衡状态,要使该反应达到平衡状态,应该向正反应方向移动;
D.醋酸是弱电解质,部分电离,常温下,0.1000mol/L的醋酸溶液pH>1;醋酸钠是强碱弱酸盐,其溶液呈碱性.
解答 解:A.升高温度,平衡向吸热反应方向移动,A的转化率增大,说明正反应是吸热反应,则△H>0,故A错误;
B.温度越高,反应速率越快,则反应达到平衡时间越短,所以甲温度大于乙;升高温度C的含量减少,说明平衡逆向移动,则正反应是放热反应,故B错误;
C.根据浓度与温度的关系知,升高温度,平衡向逆反应方向移动,正反应是放热反应;D点未达到平衡状态,要使该反应达到平衡状态,应该向正反应方向移动,则一定有V(正)>V(逆),故C正确;
D.醋酸是弱电解质,部分电离,常温下,0.1000mol/L的醋酸溶液中氢离子浓度小于0.1000mol/L,所以pH>1,即未滴加NaOH溶液时pH>1,醋酸钠是强碱弱酸盐,其溶液呈碱性,二者物质的量相等时溶液呈碱性,故D错误;
故选C.
点评 本题考查图象分析,侧重考查学生分析判断及图象识别能力,明确纵横坐标含义是解本题关键,明确平衡移动原理,易错选项是C,题目难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
10.下列各组中属于同位素关系的是( )
| A. | 金刚石与石墨 | B. | T2O与H2O | C. | 40K与39K | D. | 16O与16O2- |
11.下列各组数值表示有关元素的原子序数,其所表示的各原子中,能以离子键相互结合成AB2型稳定化合物的是( )
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
8.下列变化需克服相同类型作用力的是( )
| A. | 溴和汞的气化 | B. | 二氧化硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 碘和干冰的升华 |
5.在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)?2C(g),下列说法能证明这一反应已经达到化学平衡状态的是( )
| A. | 单位时间消耗nmol A,同时生成2nmolC | |
| B. | A,B,C的分子数之比为1:2:3 | |
| C. | A,B,C的浓度相等 | |
| D. | 生成C的速率与分解C的速率相等 |
12.己烯雌酚是一种激素类药物,结构如图.下列有关叙述中不正确的是( )
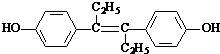

| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,一定有14个碳原子共平面 |
9.在一定条件下,对于在密闭容器中进行的反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
| A. | 达到化学平衡时,v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成2mol NO的同时消耗2 molNH3 | |
| C. | NH3、O2、NO、H2O在容器中共存 | |
| D. | c(NH3)保持不变 |
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
 .
. ,反应类型取代反应.
,反应类型取代反应.