题目内容
19.1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2L氢气(标准状况),则A分子中必有一个羟基,若此基在碳链的一端,则A的结构简式为CH3CH2CH2OH.A与浓硫酸共热,分子内脱去1分子水,生成B,反应的方程式为CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O;B通入溴水能发生加成反应.分析 n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,该有机物丙醇,若羟基在碳链的一端,应为CH3CH2CH2OH,在浓硫酸作用下可生成CH3CH=CH2,与溴水发生加成反应可生成CH3CHBrCH2Br.
解答 解:1molC3H8O与Na反应生成氢气为:n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,则C3H8O含有1个羟基,若羟基在碳链的一端,且A中无支链,则A应为CH3CH2CH2OH;
在浓硫酸作用下,CH3CH2CH2OH发生消去反应生成B为CH3CH=CH2,反应方程式为:CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,CH3CH=CH2与溴水发生加成反应:CH3CH=CH2+Br2→CH3CHBr-CH2Br,
故答案为:羟;CH3CH2CH2OH;CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O;加成.
点评 本题考查有机物官能团结构与性质、有机反应类型、有机反应方程式书写等知识,题目难度中等,注意熟练掌握常见有机物结构与性质,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
9.在一定条件下,对于在密闭容器中进行的反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
| A. | 达到化学平衡时,v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成2mol NO的同时消耗2 molNH3 | |
| C. | NH3、O2、NO、H2O在容器中共存 | |
| D. | c(NH3)保持不变 |
10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是( )
| A. | R元素处于第三周期ⅥA族 | B. | R元素是较活泼的非金属元素 | ||
| C. | 原子核外共有14个电子 | D. | 元素最低化合价为-2价 |
7.在元素周期表中有很多的规律与特点,下列说法不正确的是( )
| A. | 两种不同的元素不可能既在同一周期,又在同一主族 | |
| B. | 元素周期表中的元素不全是从自然界中发现的 | |
| C. | 周期表中共1-20号元素,含有非金属11种 | |
| D. | 若周期表中第8周期完全填满,此周期应含有有50种元素 |
14.已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D、T,从水分子的组成来看,自然界的水一共有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 18种 |
4.由碘乙烷制取乙二醇,依次发生反应的类型是( )
| A. | 取代、加成、水解 | B. | 消去、加成、取代 | C. | 水解、消去、加成 | D. | 消去、水解、取代 |
14.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 28 g聚乙烯中含有的碳原子数目为2NA | |
| D. | 1 mol C${{H}_{5}}^{+}$中含有的电子数目为11NA |
 .
.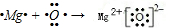 .
.