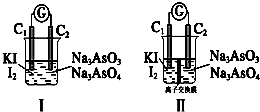题目内容
7.以下物质既能够使溴水褪色,又能够与钠反应放出氢气,但不能使pH试纸变色的是( )| A. | CH2=CH-COOH | B. | CH2=CH-COOCH3 | C. | CH3CH2OH | D. | CH2=CH-CH2OH |
分析 既能够使溴水褪色,则含碳碳双键、碳碳三键等,又能够与钠反应放出氢气,则含-OH、-COOH等,但不能使pH试纸变色,则不含-COOH,综上可知,有机物中含双键、-OH,以此来解答.
解答 解:A.含-COOH,能使pH试纸变色,故A不选;
B.含碳碳双键与-COOC-,不能与钠反应放出氢气,故B不选;
C.不含碳碳双键,与溴水不反应,故C不选;
D.含碳碳双键及-OH,既能够使溴水褪色,又能够与钠反应放出氢气,但不能使pH试纸变色,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、烯烃、羧酸等有机物性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.下列实验方案不合理的是( )
| A. | 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液 | |
| D. | 鉴别乙烷和乙烯:将两种气体分别通入溴的四氯化碳溶液中 |
15.酚酞的结构简式如图,下列关于酚酞的说法一定正确的是( )
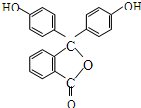

| A. | 酚酞的分子式是C20H12O4 | B. | 分子中的所有碳原子不在同一平面 | ||
| C. | 1mol酚酞最多可能消耗2mol NaOH | D. | 1mol酚酞可与10mol H2加成 |
2.从环境保护的角度出发,下列做法正确的是( )
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
16.下列物质不可能含有离子键的是( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
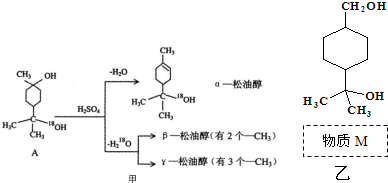
 .
. .
.