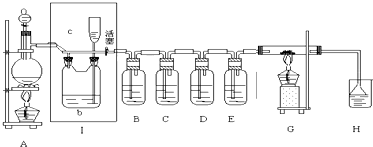
题目内容
6.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1.下列有关结论正确的是( )| A. | x的值为1 | |
| B. | 用B的浓度变化表示的平均反应速率为0.2 mol•L-1•min-1 | |
| C. | 反应开始前A的物质的量为3 mol | |
| D. | 5 min时A的浓度为0.2 mol•L-1 |
分析 设A、B的物质的量为nmol,依据方程式3A(g)+B(g)?xC(g)+2D(g),列三段,依据C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1,则C生成的物质的量为0.1mol•L-1•min-1×2L×5min=1mol,依据转化量之比等于反应物、生成物转化量之比计算消耗的A、B,生成的C、D,补充三段式,再根据物质的量浓度公式计算浓度;反应速率之比即为计量数之比,根据C的反应速率求A的反应速率,据此解答.
解答 解:设A、B的物质的量为nmol,经5min后测得D的浓度为0.5mol•L-1,则D的物质的量为0.5mol•L-1×2L=1mol,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1,则生成的C的物质的量为0.1mol•L-1•min-1
×2L×5min=1mol,则:
3A(g)+B(g)=xC(g)+2D(g),
起始量 n mol n mol 0 0
转化量 1.5mol 0.5mol 1mol 1mol
5min(n-1.5)mol( n-0.5)mol 1mol 1mol
转化量之比等于计量系数之比,所以x:2=1:1,解得x=2;
速率之比等于计量系数之比,所以V(B):V(C)=1:2,V(C)=0.1mol•L-1•min-1,V(B)=0.05mol•L-1•min-1;
c(A):c(B)=3:5,所以(n-1.5):( n-0.5)=3:5,解得n=3;
5 min时A的浓度=$\frac{n}{V}$=$\frac{1.5mol}{2L}$=0.75mol/L,
A.x的值为2,故A错误;
B.用B的浓度变化表示的平均反应速率为0.05mol•L-1•min-1,故B错误;
C.反应开始前A的物质的量为3 mol,故C正确;
D.5 min时A的浓度为0.75mol•L-1,故D错误;
故选:C.
点评 本题考查了化学反应速率与化学计量数的关系,明确方程式系数、转化量、反应速率之比之间的关系,准确列出三段式是解题关键,题目难度中等.

 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点c处反应达到平衡 | |
| B. | 点a的正反应速率比点b的大 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其它条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小 |
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图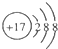 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
| A. | CaCl2 | B. | Ne | C. | Br2 | D. | Na2O |
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |