题目内容
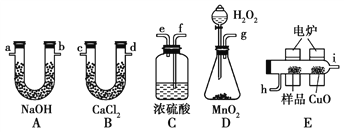
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.已知:Na2SO3(aq)+S(s)![]() Na2S2O3(aq),实验可知该反应较慢。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
Na2S2O3(aq),实验可知该反应较慢。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
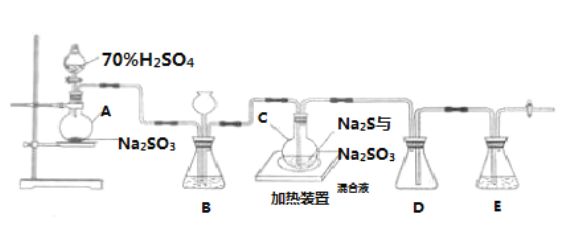
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若_______,则整个装置气密性良好。装置D的作用是______________________________________ 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___________。
a.蒸馏水 b .饱和Na2SO3溶液
c.饱和NaHSO3溶液 d . 饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。烧瓶C中反应达到终点的现象是____________________。待C中反应完成后应立即关闭分液漏斗的旋塞,原因是_______________________。
(3)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:_______________________________________________。供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
【答案】液柱高度保持不变 防止倒吸 c 控制滴加硫酸的速度(合理即可) 溶液变澄清(或浑浊消失) 过量的二氧化硫使得溶液显酸性,Na2S2O3在酸性条件下会分解(或Na2S2O3在酸性条件下不稳定) 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
【解析】
(1)利用液面差在一段时间不变检验装置气密性;根据装置特点判断其作用;
(2)根据SO2的溶解性和化学性质选择合适的试剂;根据反应原理判断烧瓶C中反应达到终点的现象;根据已知信息Na2S2O3在中性或碱性环境中稳定,在酸性条件下不稳定会分解分析;
(3)检测产品中是否存在Na2SO4,先加盐酸排除干扰,再利用氯化钡检验硫酸根离子。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则整个装置气密性良好,D中左侧为短导管可防止液体倒吸,故答案为:液柱高度保持不变;防止倒吸;
(2)装置B的作用之一是观察SO2的生成速率,SO2易溶于水,能与饱和Na2SO3溶液、饱和NaHCO3溶液反应,因此不可选,SO2与饱和NaHSO3溶液不反应,且在NaHSO3溶液的溶解度小,则可用饱和NaHSO3溶液观察SO2的生成速率;实验中为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度;反应Na2SO3(aq)+S(s)![]() Na2S2O3(aq)相对较慢,反应达到终点时S完全溶解,可观察到溶液变澄清(或浑浊消失),所以烧瓶C中反应达到终点的现象为溶液变澄清(或浑浊消失);过量的二氧化硫使溶液呈酸性,Na2S2O3在酸性条件下不稳定会分解,则C中反应完成后,应立即关闭漏斗旋塞,停止加热,故答案为:c;控制滴加硫酸的速度(合理即可);溶液变澄清(或浑浊消失);过量的二氧化硫使得溶液显酸性,Na2S2O3在酸性条件下会分解(或Na2S2O3在酸性条件下不稳定);
Na2S2O3(aq)相对较慢,反应达到终点时S完全溶解,可观察到溶液变澄清(或浑浊消失),所以烧瓶C中反应达到终点的现象为溶液变澄清(或浑浊消失);过量的二氧化硫使溶液呈酸性,Na2S2O3在酸性条件下不稳定会分解,则C中反应完成后,应立即关闭漏斗旋塞,停止加热,故答案为:c;控制滴加硫酸的速度(合理即可);溶液变澄清(或浑浊消失);过量的二氧化硫使得溶液显酸性,Na2S2O3在酸性条件下会分解(或Na2S2O3在酸性条件下不稳定);
(3)BaS2O3、BaSO3均为白色沉淀,且S2O32-+2H+=S↓+SO2↑+H2O,则检测产品中是否存在Na2SO4,操作、现象和结论为取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。回答下列问题:
(1)乙烷可通过热裂解和氧化裂解制取乙烯。已知下列键能数据:
化学键 | C—C | C=C | C—H | H—H |
键能/ kJ·mol -1 | 347. 7 | 615 | 413. 4 | 436. 0 |
①乙烷直接裂解制乙烯的热化学方程式为_____________________________。
②氧化裂解制乙烯的热化学方程式为C2H6(g) + ![]() O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
(2)利用生物乙醇在某种分子筛催化下可脱水制取乙烯,相应反应如下:
I. C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
Ⅱ. 2C2H5OH(g) ![]() (C2H5)2O(g) + H2O(g)
(C2H5)2O(g) + H2O(g)
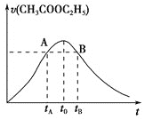
平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]及产品选择性如下图所示:

①反应 C2H5OH(g) ![]() C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
②关于上图中交点M,下列说法正确的是________(填字母)。
a. 一段时间内,反应I、Ⅱ的速率相等
b. 某温度下,反应I、Ⅱ的平衡常数相等
c. 一段时间内,反应I、Ⅱ中乙醇的转化率相等
(3)利用煤制合成气,再由合成气间接制乙烯包含的反应有:
I. CO(g) +2H2(g) ![]() CH3OH(g) △H=a kJ·mol-1
CH3OH(g) △H=a kJ·mol-1
Ⅱ. 2CH3QH(g) ![]() C2H4(g) + 2H2O(g) △H =b kJ·mol-1
C2H4(g) + 2H2O(g) △H =b kJ·mol-1
①反应 2CO(g) + 4H2(g) ![]() C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
②在容积为1 L的密闭容器中,投入2 mol CO和4 mol H2,10 min后,测得c(CO) = 1. 2 mol·L-1·min-1,则10 min内v(H2)=_____________ mol·L-1·min-1。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 污泥中Cr(III)的处理工艺流程如下。

已知:①硫酸浸取后溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+;
②CrOH(H2O)5SO4难溶于水。
(1)浓H2O2溶液的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:____________。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 5.2 | 5.6 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为Cr2O42-,其离子方程式为______________________。此步骤中滤液的pH调至8,通过沉淀除去的金属离子为___________;此步骤中没有继续调高将Mg2+除去,理由是______________________。
(3)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用该方法主要除去的滤液II中的Mg2+, 若测得滤液II通过钠离子交换柱后溶液中c(Na+)为amol/L,则滤液II中c(Mg2+)为___________。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________________________。