题目内容
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
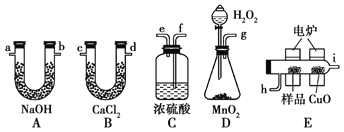
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________(填字母)。
(2)装置C中浓硫酸的作用是_____________________________________。
(3)燃烧管中CuO的作用是________________________________。
(4)若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g,则该有机物的实验式为________。
(5)要确定该有机物的分子式,还要知道该有机物的____,经测定其蒸气密度为 2.054 g/L(已换算为标准状况),则其分子式为______。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为____。

【答案】 g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 确保有机物中的碳元素全部转化为CO2 C2H6O 相对分子质量 C2H6O CH3CH2OH
【解析】(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选择装置各导管的连接顺序是g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,即装置C中浓硫酸的作用是干燥O2。(3)一氧化碳能与氧化铜反应,可被氧化成二氧化碳,因此CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;(4)n(CO2)= ![]()
![]() =0.03 mol,n(H2O)=
=0.03 mol,n(H2O)= ![]()
![]() =0.045 mol,m(O)=0.69 g-m(C)-m(H)=0.69 g0.03 mol×12 g·mol-1-0.045 mol×2×1 g·mol-1=0.24 g,n(O)=
=0.045 mol,m(O)=0.69 g-m(C)-m(H)=0.69 g0.03 mol×12 g·mol-1-0.045 mol×2×1 g·mol-1=0.24 g,n(O)= ![]()
![]() =0.015 mol,故其实验式为C2H6O。(5)要确定该有机物的分子式,还要知道该有机物的相对分子质量,M=Vm ρ=22.4 L/mol×2.054 g/L≈46 g/mol,即该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O。(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式为CH3CH2OH。
=0.015 mol,故其实验式为C2H6O。(5)要确定该有机物的分子式,还要知道该有机物的相对分子质量,M=Vm ρ=22.4 L/mol×2.054 g/L≈46 g/mol,即该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O。(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式为CH3CH2OH。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】下列操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 乙醇和重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
A. A B. B C. C D. D
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。


