题目内容
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |

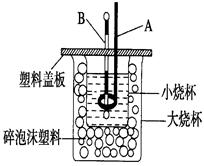
①请指出该装置还缺少的仪器是 ;
②两烧杯间填满碎泡沫塑料的作用是 ;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是 (由大到小)。
(1)-488.3kJ/mo1(2分)
(2)C(2分)
(3)①环形玻璃搅拌棒(2分) ②为了达到保温隔热,减少热量损失(2分) ③Q2>Q3>Ql(2分)
解析试题分析:⑴2C(s)+2H2(g)+O2(g)=CH3COOH(l) 可由②+③×2-①得到,△H=△H2+2△H3―△H1= -393.5kJ/mo1―285.8kJ/mo1×2+870.3kJ/mo1=-488.3kJ/mo1,答案:-488.3kJ/mo1;⑵A、是放热反应且反应后熵增;B、是放热反应且反应后熵减;C、是吸热反应且反应后熵增;D是放热反应且反应后熵增,故选C。⑶①该装置还缺少的仪器是环形玻璃搅拌棒, 使反应更完全。② 两烧杯间填满碎泡沫塑料的作用是为了达到保温隔热,减少热量损失,提高测量的准确性。答案: ①环形玻璃搅拌棒;②为了达到保温隔热,减少热量损失;⑶醋酸是弱酸,电离吸热较多,浓硫酸稀释放热,所以入出的热量Q2> Q3> Ql,答案:Q2> Q3> Ql。
考点:化学反应热及测量

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案CO2和CO是工业排放的对环境产生影响的废气。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O。制得的CH3OH可用作燃料电池的燃料。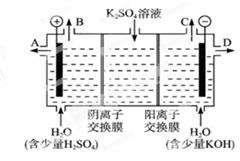
①在KOH介质中,负极的电极反应式为_________________________________。
②作介质的KOH可以用电解K2SO4溶液的方法制得。则KOH在_______出口得到,阳极的电极反应式是:_____________________________________。
(3)利用CO与H2反应可合成CH3OCH3。
已知:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是 .
| A.低温高压; | B.加入催化剂; | C.体积不变充入氦气; | D.增加CO的浓度;E.分离出二甲醚 |
 CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
①0-10 min内反应速率v(CH3OH) = 。
②该温度下的平衡常数为 。
③若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正 v逆 (填“>”、“<”或“=”)。
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H="-574kJ/mol"
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H="-1160kJ/mol"
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式 。
(2)用活性炭还原法处理氮氧化物,有关反应为:
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下: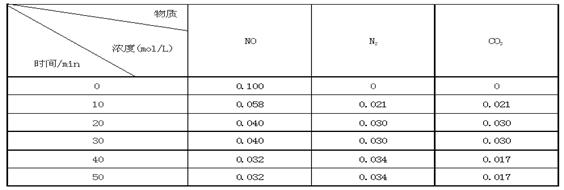
①不能作为判断反应达到化学平衡状态的依据是_______ ;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)= 。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是_______ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为: 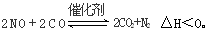
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验编号 | T(0C) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比 表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | b | c | 124 |
| Ⅲ | 350 | d | e | 124 |
上表中:a=_______,b=________,e=________ 。
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=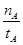 (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时的平衡常数比T2时的大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 。
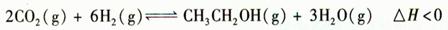

 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol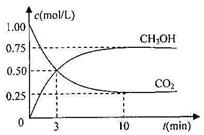
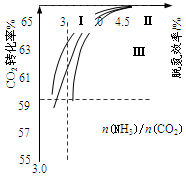
 CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。