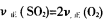题目内容
已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出________kJ热量。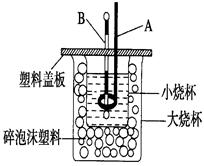
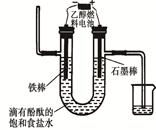
(2)如图装置中仪器A的名称是 ,碎泡沫塑料的作用是 。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能是
。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
(1)11.46
(2)环形玻璃搅拌棒;隔热,减少热量散失
(3)实验过程中难免有热量散失(合理答案均可)
(4)偏小
解析试题分析:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ·mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,答案为:11.46;
(2)仪器A的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:环形玻璃搅拌棒;隔热,减少热量散失,答案为:环形玻璃搅拌棒;隔热,减少热量散失;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ·mol-1,答案为:实验过程中难免有热量散失;(合理答案均可)
(4)醋酸为弱酸,电离过程为吸热过程,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小;
考点:中和热的测定

化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |

①请指出该装置还缺少的仪器是 ;
②两烧杯间填满碎泡沫塑料的作用是 ;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是 (由大到小)。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
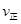 _________
_________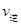 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)
(14分)CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图所示。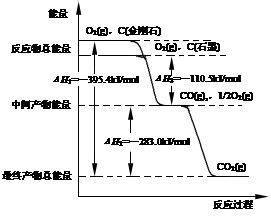
①在通常状况下,金刚石和石墨中, (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 kJ·mol-1。
②石墨与CO2反应生成CO的热化学方程式: 。
(2)采用电化学法可将CO2转化为甲烷。试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式 。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g) 与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
则:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。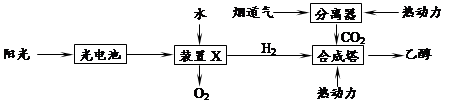
对上述流程的分析,下列说法正确的是 。
| A.该流程至少包含4种形式的能量转化 |
| B.装置X中阴极反应为:2H2O-4e-=4H++O2↑ |
| C.合成塔中生成乙醇的反应是化合反应 |
| D.流程设计体现了绿色化学思想 |
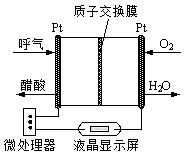
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0·30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g)
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
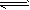 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
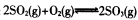 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题