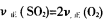题目内容
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H="-574kJ/mol"
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H="-1160kJ/mol"
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式 。
(2)用活性炭还原法处理氮氧化物,有关反应为:
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下: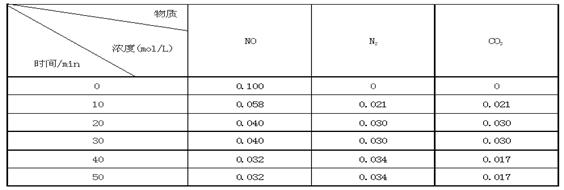
①不能作为判断反应达到化学平衡状态的依据是_______ ;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)= 。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是_______ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为: 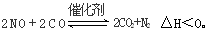
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验编号 | T(0C) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比 表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | b | c | 124 |
| Ⅲ | 350 | d | e | 124 |
上表中:a=_______,b=________,e=________ 。
Ⅰ:9ml或14.25ml
Ⅱ:(1) CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H="-955" kJ/mol
(2)①BC ②0.003mol·L-1· min-1 ③0.56 ④减小CO2 的浓度
(3)a=280℃ b= 1.20×10-3 e=5.80×10-3
解析试题分析:(Ⅰ)往充满NO的试管中充入氧气并倒扣在水槽,发生的反应是4NO + 3O2 +2H2O = 4HNO3,最终剩余的气体可能是NO或O2;所以设氧气体积总共为X,
则①剩余氧气3ml时,4NO + 3O2 +2H2O = 4HNO3 ②剩余NO 3ml时,4NO + 3O2 +2H2O = 4HNO3
4: 3 4 :3
15ml X 15ml X
X="15×3/4" + 3 =14.25ml X=(15-3)×3/4 =9ml
(Ⅱ) (1) 据已知方程式可知目标方程式可以由方程式(①+②+③×4)÷2 得
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l),而△H=(△H1+△H2+4×△H3)÷2=" -955" kJ/mol
(2)在反应C(s)+2NO(g)= N2(g)+CO2(g)中,要判断是否达到平衡,要找变量,变量不变则达到平衡。容器内CO2的浓度是变量,保持不变时说明达到平衡,A正确;v正(N2)="2" v正(NO)表示的都是正反应的速率关系,不能说明正逆反应速率相等,所以不能判断平衡,B错误;反应方程式的前后系数相等,所以容器内压强随着反应保持不变,所以不能判断平衡,C错误;密闭容器是恒容,容器内总质量不变,但由于有固体参加,混合气体的质量是个变量,据ρ=m气/V知,当气体质量不变时,混合气体的密度保持不变,此时反应达到平衡,D正确; 同样混合气体的质量是个变量,据M=m气/n气 知,M也是个变量,当M保持不变时达到平衡,E正确。故选BC。
(3)v(NO)=(0.1- 0.04)mol·L-1/ 20min = 0.003mol·L-1· min-1
据表格数据可知,当反应达到20min时,各物质浓度不再变化反应达到第一次平衡,平衡常数
K=C(N2)·C(CO2)/ C2(NO)=0.032/0.042 =0.56 ;反应在40min时,各物质浓度发生变化,且C(CO2)浓度减小最多,平衡往正反应方向移动,所以改变的条件是减小CO2 的浓度。
(4)实验要验证的是温度、催化剂的比表面积对化学反应速率的影响规律,所以对比试验要控制变量,所以a=280℃ b= 1.20×10-3 e=5.80×10-3 。
考点:本题考查的是氮氧化物的计算、反应与能量计算、反应速率和平衡和常数的计算以及影响因素,考查的计算各种各样,综合能力强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。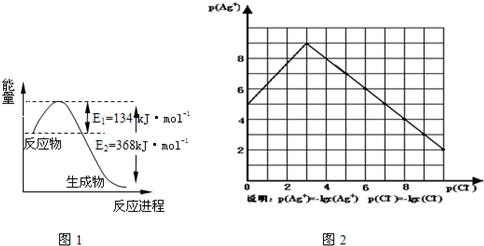
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)  2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1____K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是____一(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=)
N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=) 常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g) + e—
 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1PtF6(g) + e—= PtF6—(g)
 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1O2+PtF6—(s) = O2+(g) + PtF6—(g)
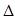 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1则反应O2(g) + (g) = O2+PtF6— (s)
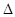 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |

①请指出该装置还缺少的仪器是 ;
②两烧杯间填满碎泡沫塑料的作用是 ;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是 (由大到小)。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
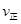 _________
_________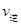 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)
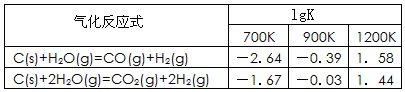
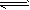 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
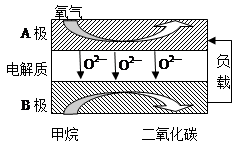
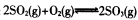 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题