题目内容
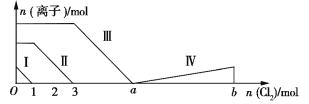
【题目】向含Fe2+、I、Br的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知ba=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
A. 线段Ⅱ表示Br的变化情况
B. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
C. 根据图象无法计算a的值
D. 线段Ⅳ表示![]() 的变化情况
的变化情况
【答案】D
【解析】
向仅含Fe2+、I﹣、Br﹣的溶液中通入适量氯气,还原性I﹣>Fe2+>Br﹣,首先发生反应2I﹣+Cl2=I2+2Cl﹣,I﹣反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl﹣,Fe2+反应完毕,最后发生反应2Br﹣+Cl2=Br2+2Cl﹣,故线段I代表I﹣的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br﹣的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I﹣)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol﹣1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I﹣)+n(Br﹣)=2n(Fe2+),故n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,
A.根据分析可知,线段Ⅱ为亚铁离子被氯气氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣,不是氧化溴离子,故A错误;
B.n(FeI2):n(FeBr2)=n(I﹣):n(Br﹣)=2mol:6mol=1:3,故B错误;
C.由分析可知,溶液中n(Br﹣)=2n(Fe2+)﹣n(I﹣)=2×4mol﹣2mol=6mol,根据2Br﹣+Cl2=Br2+2Cl﹣可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故C错误;
D.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,已知碘单质的物质的量为2mol,反应消耗氯气的物质的量为5mol,根据电子守恒,则该含氧酸中碘元素的化合价为:![]() =+5价,则该含氧酸为HIO3,即:线段Ⅳ表示IO3﹣的变化情况,故D正确;
=+5价,则该含氧酸为HIO3,即:线段Ⅳ表示IO3﹣的变化情况,故D正确;

【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D