题目内容
【题目】食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图: 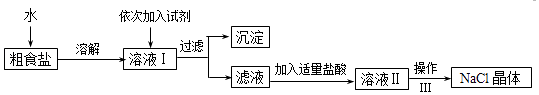
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)从上述提供的试剂中选出适当的试剂除去溶液I中的Ca2+、Mg2+、SO42﹣离子,滴加顺序依次为、、(只填化学式).
(2)操作Ⅲ的名称是 , 所需用到的仪器主要有铁架台、酒精灯、铁圈、(填仪器名称).
(3)加盐酸的目的是(用离子方程式表示)、 .
【答案】
(1)NaOH;BaCl2;Na2CO3
(2)蒸发结晶;蒸发皿、玻璃棒
(3)H++OH﹣=H2O;2H++CO32﹣=H2O+CO2↑
【解析】解:(1)要除去SO42﹣ , 只有选BaCl2溶液,若选用Ba(NO3)2 , 会引入新的离子NO3﹣ , 再选用NaOH溶液除去Mg2+溶液,最后选用Na2CO3溶液除去Ca2+ , 此处不能选用K2CO3溶液,否则会引入新的K+ , 再用HCl除去过量的CO32﹣ , Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+ , 所以答案是:BaCl2、NaOH、Na2CO3或NaOH、BaCl2、Na2CO3;(2)得到NaCl晶体,需要蒸发结晶操作,该装置所需用到的仪器主要有铁架台、酒精灯、铁圈、蒸发皿、玻璃棒;所以答案是:蒸发结晶;蒸发皿、玻璃棒;(3)加入盐酸除去NaOH和碳酸钠,离子方程式为H++OH﹣=H2O、2H++CO32﹣=H2O+CO2↑,
所以答案是:H++OH﹣=H2O;2H++CO32﹣=H2O+CO2↑.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
