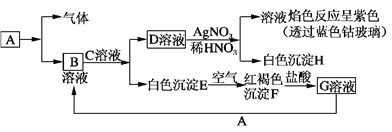
题目内容
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
【答案】D
【解析】由图象知,当pH值与其它条件相同,温度越高,Fe2+的氧化率越大;当温度和其它条件相同,pH值越大,Fe2+的氧化率越小。A、方程式电荷不守恒,配平错误,正确的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故A错误;B、Fe2+的氧化率受PH值和温度的影响,所以pH=1.5时氧化率不一定比pH=2.5时大,故B错误;C、Fe2+的氧化率不仅与溶液的pH和温度有关,还与离子的浓度等其它因素有关,故C错误;D、其它条件相同时温度不同时,Fe2+的氧化率与温度呈正比,温度越高氧化率越大,故D正确。故选D。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目