题目内容
3.常温下,将四份质量相同的铝片分别投入下列足量的酸中,产生同等条件下气体最多的是( )| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 稀盐酸 |
分析 在常温下,金属铝和浓硫酸、浓硝酸会发生钝化,不会产生气体,在加热时,可以和稀硝酸以及盐酸反应,根据反应的方程式:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O、2Al+6HCl=2Al(Cl)3+3H2↑进行计算.
解答 解:在常温下,金属铝和浓硫酸、浓硝酸会发生钝化,不会产生气体,在加热时,可以和稀硝酸以及盐酸反应,根据反应的方程式:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O、2Al+6HCl=2Al(Cl)3+3H2↑,质量相同的铝片则物质的量相等,假设都是1mol,则产生氢气的物质的量更多.故选D.
点评 此题考查的是Al与酸反应中的性质及其中相关的量的关系,要熟记发生的反应并进向相应的计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.25℃时,用浓度为0.100mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.100mol/L的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断正确的是( )
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
11.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丁烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
8.下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
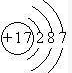
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为 .
.
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.

15.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)A组属于原子晶体,其熔化时克服的粒子间的作用力是化学键.
(2)B组晶体共同的物理性质是②③④(填序号).
①硬度大 ②导电性 ③导热性 ④延展性
(3)D组晶体可能具有的性质是②④(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高.
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1710 | Rb:39 | HI:-51 | CsCl:645 |
(1)A组属于原子晶体,其熔化时克服的粒子间的作用力是化学键.
(2)B组晶体共同的物理性质是②③④(填序号).
①硬度大 ②导电性 ③导热性 ④延展性
(3)D组晶体可能具有的性质是②④(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高.
12.(1)①下表为烯烃类化合物与溴发生加成反应的相对速率(以乙烯为标准).
据表中数据,总结烯烃类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:C=C上取代基为烃基的反应速率快,烃基越多反应速率越快,C=C上取代基为卤素原子的反应速率慢,卤素原子越多反应速率越慢.
②下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D.
A.(CH3)2C=C(CH3) 2 B.CH3CH=CHCH3C.CH2CH=CH2 D.CH2=CHCl
(2)已知A是化工生产中重要的气态烃,在标准状况下的密度为1.25g/L,现以A为主要原料合成E,其合成路线如图所示.回答下列问题:①写出A的电子式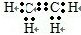 .
.
②写出下列反应的化学方程式:
第①步CH2=CH2+H2O→CH3CH2OH;
第③步2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;
③已知A在有催化剂条件下可以与氧气反应直接制得C,写出该反应的化学方程式2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO
| 烯烃类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
②下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D.
A.(CH3)2C=C(CH3) 2 B.CH3CH=CHCH3C.CH2CH=CH2 D.CH2=CHCl
(2)已知A是化工生产中重要的气态烃,在标准状况下的密度为1.25g/L,现以A为主要原料合成E,其合成路线如图所示.回答下列问题:①写出A的电子式
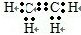 .
.②写出下列反应的化学方程式:
第①步CH2=CH2+H2O→CH3CH2OH;
第③步2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH;
③已知A在有催化剂条件下可以与氧气反应直接制得C,写出该反应的化学方程式2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO

13.下列各组比较,不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:HBr>HCl>HF | ||
| C. | 原子半径:r(Si)>r(N)>r(O) | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓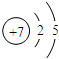 .
.