题目内容
13.下列各组比较,不正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:HBr>HCl>HF | ||
| C. | 原子半径:r(Si)>r(N)>r(O) | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B、元素的非金属性越强,对应的氢化物越稳定;
C、电子层越多,原子半径越大,同周期从左向右原子半径在减小;
D、金属性越强,则对应最高价氧化物的水化物的碱性越强;
解答 解:A、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4 故A正确;
B、非金属性F>Cl>Br,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HBr<HCl<HF,故B错误;
C、电子层越多,原子半径越大,同周期从左向右原子半径在减小,则原子半径为r(Si)>r(N)>r(O),故C正确;
D、金属性Na>Mg>Al,则对应最高价氧化物的水化物的碱性为NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
点评 本题考查元素周期表和元素周期律,熟悉金属性、非金属性的比较方法及半径的变化规律是解答本题的关键,难度不大,注意规律性知识的总结.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.常温下,将四份质量相同的铝片分别投入下列足量的酸中,产生同等条件下气体最多的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 稀盐酸 |
4.反应C(s)+H2O(g)?CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入H2使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 保持压强不变,充入N2使体系体积增大 |
1.下列指定微粒的个数比为2:1的是( )
| A. | Be2+中的质子和电子 | |
| B. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| C. | NaHC03中的阳离子和阴离子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
8.如图为香芹酮分子的结构,下列有关叙述正确的是( )


| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
18.Ag2CrO4在水中的沉淀溶解平衡曲线如图所示,t℃时,反应Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)的K=2.5×107,下列说法正确的是( )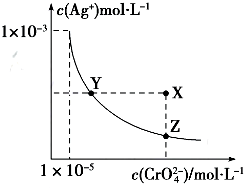

| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
6. 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
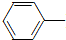 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$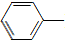 NHCOCH3+H2O
NHCOCH3+H2O
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
实验步骤如下:
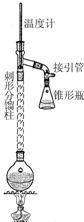
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$ NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
3.下列说法中正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可以相同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
4.某有机物的结构简式如图所示,关于该有机物的说法不正确的是( )
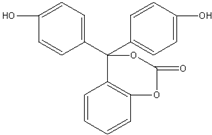

| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成、取代、氧化、消去等反应 | |
| D. | 1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol |