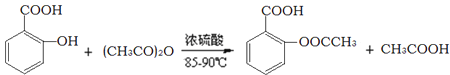
题目内容
【题目】下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.向![]() 溶液中加入等体积
溶液中加入等体积![]() 溶液:
溶液:![]()
B.物质的量浓度都为![]() 的
的![]() 与
与![]() 溶液等体积混合后,
溶液等体积混合后,![]()
C.已知常温下,![]() 的电离常数
的电离常数![]() ,
,![]() .
.![]() 溶液:
溶液:![]()
D.![]() 溶液与
溶液与![]() 溶液混合:
溶液混合:![]()
【答案】D
【解析】
A.向0.2mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液,二者反应生成碳酸钠和水,溶液中溶质为0.05mol·L-1的NaHCO3和Na2CO3;
B.物质的量浓度都为![]() 的
的![]() 与
与![]() 溶液等体积混合后,溶液变成CH3COONa溶液,根据物料守恒分析;
溶液等体积混合后,溶液变成CH3COONa溶液,根据物料守恒分析;
C.![]() 溶液要先判断水解和电离的大小,确定溶液的酸碱性;
溶液要先判断水解和电离的大小,确定溶液的酸碱性;
D.![]() 溶液与
溶液与![]() 溶液混合,相当于等物质的量浓度的NH3·H2O和NaCl的混合溶液,由此分析。
溶液混合,相当于等物质的量浓度的NH3·H2O和NaCl的混合溶液,由此分析。
A.向0.2mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液,二者反应生成碳酸钠和水,溶液中溶质为0.05mol·L-1的NaHCO3和Na2CO3,NaHCO3和Na2CO3水解导致溶液呈碱性,且碳酸钠水解程度大于碳酸氢钠,所以c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)>c(H+),故A错误;
)>c(OH-)>c(H+),故A错误;
B.物质的量浓度都为![]() 的
的![]() 与
与![]() 溶液等体积混合后,溶液变成
溶液等体积混合后,溶液变成![]() 的CH3COONa溶液,根据物料守恒,
的CH3COONa溶液,根据物料守恒,![]() ,故B错误;
,故B错误;
C.NaHC2O4溶液中水解:HC2O![]() +H2O
+H2O![]() H2C2O4+OH-,其水解平衡常数的表达式为Kh2=
H2C2O4+OH-,其水解平衡常数的表达式为Kh2=![]() ,然后变形,即上下同乘以c(H+),得到Kh2=
,然后变形,即上下同乘以c(H+),得到Kh2=![]() =1.85×10-13<
=1.85×10-13<![]() ,说明HC2O4-的电离程度大于其水解,溶液显酸性,
,说明HC2O4-的电离程度大于其水解,溶液显酸性,![]() 溶液:
溶液:![]() ,故C错误;
,故C错误;
D.![]() 溶液与
溶液与![]() 溶液混合,相当于等物质的量浓度的NH3·H2O和NaCl的混合溶液,氯化钠是强电解质,不水解,显中性,而一水合氨发生部分电离,溶液呈碱性:
溶液混合,相当于等物质的量浓度的NH3·H2O和NaCl的混合溶液,氯化钠是强电解质,不水解,显中性,而一水合氨发生部分电离,溶液呈碱性:![]() ,故D正确;
,故D正确;
故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目