题目内容
【题目】已知NA为阿伏加德罗常数的值,下列叙述正确的是
A.1L0.1mol/LNH4Cl溶液中,![]() 的数量为0.1NA
的数量为0.1NA
B.0.1mol的14C中,含有0.6NA个中子
C.标准状况下,2.24LN2和O2的混合气体中原子数为0.2NA
D.16g甲烷和1mol白磷中含有的化学键数相等
【答案】C
【解析】
A.![]() 易水解,1L0.1mol/LNH4Cl溶液中,
易水解,1L0.1mol/LNH4Cl溶液中,![]() 的数量小于0.1NA,故A错误;
的数量小于0.1NA,故A错误;
B.1个14C原子中含有8个中子,0.1mol的14C中,含有0.8NA个中子,故B错误;
C.标准状况下,2.24LN2和O2的混合气体的物质的量是0.1mol,N2和O2都是双原子分子,所以原子数为0.2NA,故C正确;
D.1个甲烷分子中含有4个共价键,1个P4分子中含有6个共价键,16g甲烷含有共价键是![]() ,1mol白磷中含有的化学键是6mol,故D错误;
,1mol白磷中含有的化学键是6mol,故D错误;
选C。

 阅读快车系列答案
阅读快车系列答案【题目】直接排放含SO2的烟气会形成酸雨危害环境。利用钠碱循环法可脱除烟气中的SO2。
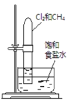
(1)用化学方程式表示SO2形成硫酸型酸雨的反应原理为__。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式为__。
(3)吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如表:
)变化关系如表:
n( | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性__(填“酸”或“碱”),用化学平衡原理解释__。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(填字母编号)__。
a.c(Na+)=2c(![]() )+c(
)+c(![]() )
)
b.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
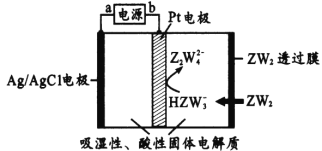
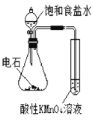
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
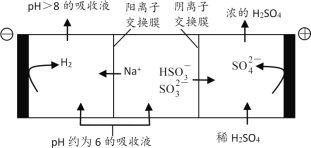
①![]() 在阳极放电的电极反应式是__。
在阳极放电的电极反应式是__。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理__。