题目内容
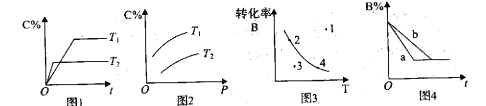
【题目】在某无色溶液中,可能含有Mg2+、Al3+、Fe2+、NH4+、H+、AlO2-、Cl-中的一种或几种离子,向其中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入的NaOH溶液体积的关系如图所示,由此确定,无色溶液中含有的离子是( )

A. Mg2+、Al3+、Fe2+、Cl-
B. H+、Mg2+、Al3+、NH4+
C. H+、Mg2+、Al3+、NH4+、Cl-
D. Mg2+、NH4+、AlO2-
【答案】C
【解析】
由题意可知,在某无色溶液中可能含有Mg2+、Al3+、Fe2+、NH4+、H+、AlO2-、Cl-中的一种或几种离子,因为溶液是无色的,故一定不含亚铁离子;向其中缓慢地滴入NaOH溶液直至过量,由图象可知,开始时无沉淀产生则原溶液中含有H+、不含有AlO2-;反应过程中产生的沉淀部分溶解于强碱,则一定含有Mg2+和Al3+,从加入氢氧化钠溶液使沉淀达到最大量至沉淀溶解,有一段沉淀的量不变,说明原溶液中含有NH4+,溶液为电中性,一定含有阴离子则一定有Cl-,答案选C。

 走进文言文系列答案
走进文言文系列答案【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5 kJ/mol
②2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol
③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7 kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:__________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
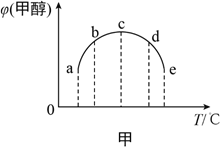
①温度升高甲醇的体积分数增大的原因是__________.
②根据图像判断ΔH__________(填“>”、“<”或“=”)0。
(3)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | A | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=__________;反应温度T1__________T2(填“大于”或“小于”。)
②容器Ⅱ中a=__________。
③下列说法能说明反应达到平衡状态的是__________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.混合气体中c(CH3OCH3)不变